Hochwertige Lebensräume statt Blühflächen
Abstracts
In den Medien werden Blühflächen und Blühstreifen als schöne, schnelle und einfache Lösung gegen das Insektensterben gepriesen. In der Landwirtschaft werden sie im Rahmen der EU-Förderprogramme, vor allem in der 2. Säule, gefördert. Neben den landwirtschaftlichen Flächen sind aber auch in Gärten und Kommunen zuletzt viele Blühflächen entstanden. Vielfach durch nichtheimische Kultur- und Zierpflanzen, aber auch durch heimische Arten nicht gebietseigener Herkünfte geprägt, sind die Effekte für die Biodiversität oft gering, bezüglich des Erhalts der genetischen Vielfalt manchmal sogar eher schädlich. Die Arbeit zeigt auf Basis bisher vorliegender Untersuchungen in acht Schritten, wie Insekten durch fachgerechte Blühflächen und naturnahe Blumenwiesen und Säume wirklich geholfen werden kann. Optimierte Landschaftspflege, Selbstbegrünung und Übertragungsverfahren sind vor jedem Einsatz von gekauftem Saatgut zu prüfen. Gebietseigenes Saatgut für mehrjährige oder dauerhafte Standflächen sowie regelmäßiges Mähen mit Mahdgutabfuhr und dem Ziel, damit dauerhaft artenreiche Wiesen entstehen zu lassen, sind wesentliche Erfolgsgaranten für einen wirkungsvollen Insektenschutz und eine effektive Erhöhung der Biodiversität.
High-quality habitats instead of flower meadows – a few steps to effective insect protection
In the media, seed-mixtures are presented as a simple and quick solution against significant insect decline. Additionally, flower strips are funded by the EU’s agricultural support, particularly within the second pillar and greening. New flower areas have come into fashion in multiple ways within private gardens, public green areas, as well as in agriculture. Based upon alien species or non-regional seed material, the effects on insect conservation are minor or non-existent; but, on the other hand, the impact on unique local gene pools is disastrous. This article presents a simple sequence of steps resulting in effective flower meadows for biodiversity; enhanced landscape management, self-greening, and modern seed transfer systems have to be considered before sowing. Effective insect conservation can be guaranteed by using native plants from seeds of regional origin to develop species-rich perennial meadows with periodic mowing and removal of cut material.
- Veröffentlicht am
Eingereicht am 28. 07. 2020, angenommen am 14. 11. 2020
1 Insektenrückgang und die Inflation der Blühflächen
Das Arten- und speziell das Insektensterben in Mitteleuropa, aber auch weltweit, ist nicht nur viel dramatischer als früher angenommen (Gatter et al. 2020, Hallmann et al. 2017, Seibold et al. 2019, Sorg et al. 2013), sondern insgesamt eines der größten Umwelt- und Naturschutzprobleme unserer Zeit und droht in kürzerer Zeitspanne ähnlich fatale oder sogar noch schlimmere Auswirkungen zu verursachen als der Klimawandel (Breeze et al. 2011, Burkle et al. 2013, EuRH 2020, Steffen et al. 2015, van Klink et al. 2020, Wenzel et al. 2006). Die Ursachen sind multifaktoriell, doch dass die Intensivierung der Landwirtschaft entscheidend dazu beiträgt, legen viele Untersuchungen nahe (zum Beispiel Hallmann et al. 2017, Seibold et al. 2019). Dabei sind für den Rückgang von Artenzahlen und Insektenmengen nicht nur der direkte Verlust und die intensivere Nutzung einzelner Lebensräume wie ehemals artenreiche Wiesen ausschlaggebend, sondern vielmehr die großräumige Intensivierung und Vereinheitlichung auf der Ebene ganzer Landschaftsausschnitte, die keine Restlebensräume mehr enthält (Ekroos et al. 2020, Seibold et al. 2019). So hängt das Vorkommen von solitären Wildbienen in der Agrarlandschaft davon ab, ob mindestens halbnatürliche Biotope mit ausreichender Pflanzenausstattung in der näheren Umgebung vorhanden sind (Abrahamczyk et al. 2020, Steffan-Dewenter et al. 2002). Zudem nehmen parallel zum Rückgang der selteneren und spezialisierten Insektenarten auch die auf spezielle Wildbienen oder Schwebfliegen angewiesenen Pflanzenarten ab, was Auswirkungen auf ganze Lebensgemeinschaften hat (zum Beispiel Bennett et al. 2020, Biesmeijer et al. 2006, Langgemach et al. 2019, Nyffeler & Bonte 2020).
Als vermeintlich wirksames Mittel gegen das Insektensterben ist die Anlage von Blühflächen und Blühstreifen derzeit sehr beliebt und seit dem erfolgreichen Volksbegehren „Rettet die Bienen“ in Bayern (Volksbegehren 2020) noch stärker als bisher in der landwirtschaftlichen Flur zu sehen. Zudem sind seitdem auch auf kommunalen Flächen und in Privatgärten bunte Blühmischungen allgegenwärtig. Sie werden in den Medien oft als wichtigste und scheinbar einfachste Maßnahme gegen den Insektenschwund beworben. Jeder braucht nur eine Samentüte auszustreuen, kurz zu warten und alle Insekten sind gerettet – so die Werbebotschaft. Auch herrschen in der landwirtschaftlichen Förderpolitik der EU gute Möglichkeiten, Blühflächen auf Äckern anzulegen. Sie können als Agrarumweltmaßnahmen in der 2. Säule der EU-Agrarförderung oder als Ökologische Vorrangflächen (ÖVF) im Greening über die erste Säule gefördert werden. Sie sollten blütenreiche, düngemittel- und pestizidfreie Flächen stellen, die Tieren Nahrung und Deckung bieten. Damit können die Landwirte vermeintlich einfach dem Insektensterben entgegenwirken, für das vielfach die moderne Landwirtschaft verantwortlich gemacht wird (BfN 2017, Bundesinformationszentrum Landwirtschaft 2020, DGfE 2016, EuRH 2020, Nuß 2016, Segerer 2019).
2 Naturschutzfachliche Aspekte zur Anlage von Blühflächen
Als Blühflächen oder -streifen werden Ansaaten aus einjährigen Kultur- und Zierpflanzen, oder im Falle der mehrjährigen Anlagen aus Kultur-, Zier- und Wildpflanzen bezeichnet. Im privaten oder kommunalen Umfeld existieren viele Mischungen unterschiedlichster Zusammensetzung, die in Bau-, Garten- und Supermärkten sowie bei diversen Organisationen erhältlich sind.
Wiesen und Säume sind im Gegensatz dazu durch veränderte Bewirtschaftung (zum Beispiel nach Gehölzrodung, Auflösung von Allmenden und dergleichen) aus anderen Lebensräumen entwickelt worden (Poschlod 2015). Manche wurden dazu auch bereits vor Jahrzehnten von den Landnutzern mit heimischen Wildpflanzen eingesät.
Insgesamt locken Blühstreifen und Blühflächen zweifellos Honigbienen sowie andere Insekten an und können auch die Menge und – wenn artenreiches, gebietseigenes Saatgut verwendet wurde – auch die Artenzahlen der Insekten, erhöhen (Buhk et al. 2018, Haaland et al. 2011). Gleiches gilt für komplex gestaltete Flächenkonzepte auf Ebene größerer Landschaftsausschnitte, bei denen die Zusammensetzung der Blühmischungen, die Ausaatzeitpunkte und die Verteilung in der Flur gut aufeinander abgestimmt sind (Buhk et al. 2018, Oppermann et al. 2019). Mit wenigen Ausnahmen zeigen allerdings die Studien über Blühflächen und deren Besiedlung, dass sie den ihnen zugesprochenen hohen Anspruch, die Vielfalt der Insekten zu stützen, meist nicht erfüllen.
2.1 Einjährige Mischungen
Gängige einjährige Mischungen für den Hausgarten enthalten meist überwiegend Zierpflanzen und fremdländische Arten (Abb. 1). Eine Aussaat beispielsweise des besonders bunten „Mössinger Sommer®“ (Radtke 2019) oder des „Visselhöveder Insektenparadies“ bringt allerdings nur wenig für den Artenschutz oder verschlechtert manchmal sogar die ökologische Wertigkeit einer Fläche. So locken diese Mischungen vorwiegend Honigbienen sowie wenige häufige Hummel-, Wildbienen- und Schwebfliegen-Generalisten an (Buch & Jagel 2019, Dieterich et al. 2016, Mandery et al. 2018, Oppermann et al. 2013, Schmid-Egger & Witt 2014, Wagner et al. 2014; Abb. 2).
Als mittelfristiger Lebensraum für heimische Wildinsekten spielen sie zudem kaum eine Rolle, da nur wenige Arten hier eine Larvalentwicklung, Verpuppung oder Überwinterung abschließen können. Positive Aspekte beschränken sich hier vielfach auf Ästhetik, einen Bewusstseinswandel gegenüber bislang versiegelten Flächen und Vielschnittrasen, oder einen deutlich reduzierten Dünger- und Pestizideinsatz. Insgesamt steht hier einem hohen Aufwand (auf landwirtschaftlichen Flächen mit nennenswerten Fördergeldern) nur ein minimaler Vorteil für die heimische Insektenwelt gegenüber (Tab. 1). Sie sollten daher nicht verwendet oder ausschließlich im Hausgarten ausgesät werden (StMUV 2020). Die einjährigen Mischungen für Agrarumweltmaßnahmen oder das Greening enthalten meist ausschließlich Kulturpflanzen wie Sonnenblumen, Büschelschön, Flachs und Buchweizen sowie meist einige Gewürzpflanzen (Abb. 3).
2.2 Mehrjährige Mischungen
Mehrjährige Mischungen bringen einen deutlich höheren Nutzen für die Natur. Allerdings sind viele der weit verbreiteten mehrjährigen Mischungen aus Sicht des Insektenschutzes wie auch hinsichtlich einer möglichen Florenverfälschung kritisch zu betrachten. In den meisten Fällen bieten sie im Gegensatz zu aus gebietseigenen Arten aufgebauten Ansaaten den spezialisierten und selteneren Insekten kaum Lebensraum (Buch & Jagel 2019, Dieterich et al. 2016, Dietzel et al. 2019, Haaland et al. 2011, Kleijn et al. 2006, Kleijn & Sutherland 2003, Mandery et al. 2018, Oppermann et al. 2013, Oppermann et al. 2019, Scheper et al. 2013, Schmid-Egger & Witt 2014, Wagner et al. 2014).
Die mehrjährigen Mischungen für die Agrarumweltmaßnahmen zum Beispiel des Kulturlandschaftsprogramms in Bayern bieten eine fachlich gute Auswahl überwiegend heimischer Arten. Allerdings werden nur Mischungen für ganz Bayern angeboten, die die in der Erhaltungsmischungsverordnung festgelegten Ursprungsgebiete für gebietseigenes Saatgut bislang nicht berücksichtigen (LfL 2020; Abb. 4, Tab. 1). Mengenmäßig überwiegen meist die Samen von Kultur- und Zierpflanzen. Diese locken zwar einige bestäubende Insekten an, doch bleiben die Artenzahl und die Zahl naturschutzfachlich relevanter Arten meist gering.
Leider existieren bisher in den Agrarumwelt- und Klimaschutzmaßnahmen (AUKM) keine Fördermöglichkeiten für mehrjährige, gebietseigene Blühflächen. Diese sollten eingeführt werden und – entsprechend den deutlich höheren Saatgutkosten – ausreichend hoch dotiert werden. Um mögliche Florenverfälschungen durch AUKM-Mischungen zu verhindern, fordern bereits die Bundesländer Brandenburg und Sachsen-Anhalt, ausschließlich gebietseigene Pflanzenherkünfte in derartigen Mischungen zu verwenden.
Immerhin bieten alle mehrjährigen Blühflächen ungedüngte, pestizidfreie Überwinterungsflächen und Deckung für Insekten und Wildtiere wie Rehe, Hasen, Igel und Rebhühner und können daher vor allem auf Gunststandorten eine Bereicherung zur restlichen intensiven Agrarlandschaft darstellen. Auch aus agroökonomischer Sicht fallen bei der derzeitigen Förderung mehrjährige Blühflächen überwiegend deutlich positiver als einjährige Mischungen aus (Albrecht et al. 2020, Uyttenbroeck et al. 2016). Leider übersteigt die Förderhöhe der Blühflächenansaaten sogar oft diejenige für extensive Ackerbewirtschaftung. Allerdings können nur in reich strukturierten Agrarlandschaften mit ausreichend Lebensraumstrukturen wie grabbaren Erdwänden oder Offenboden und Totholz oder bei sehr heterogener Verteilung und bei hohem Flächenanteil die Blühflächen durch ihr großes Nektarangebot auch seltene Arten anlocken (Buhk et al. 2018, Haaland et al. 2011, Mandery & Müller 2019). Entscheidend für das Überleben der Tiere sind hier aber weniger die Blühflächen selbst, sondern ein günstiges, strukturreiches Umfeld (Steffan-Dewenter & Tscharntke 1999, Steffan-Dewenter et al. 2002, Seibold et al. 2019).
2.3 Vergleich verschiedener Anlageverfahren
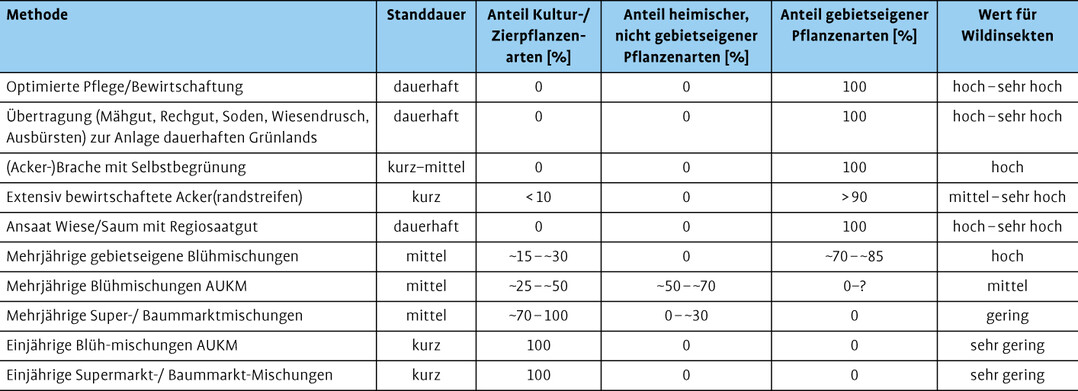
Auf Grundlage der bisherigen Erfahrungen und der ausgewerteten Literatur können die verschiedenen Mischungen vorläufig zusammengefasst und bewertet werden. So kann die naturschutzfachliche Bedeutung der verschiedenen Ansaaten für heimische Insekten untereinander als auch im Vergleich mit Verfahren zur Verbesserung oder Neuanlage von dauerhaftem Grünland eingeschätzt werden (Tab. 1).
3 Genetische Aspekte und Gründe für die Wahl gebietsheimischer Pflanzen
Um Florenverfälschung einzudämmen, regelt § 40 Abs. 1 BNatSchG, dass seit März 2020 in der freien Natur – von Ausnahmen abgesehen – nur gebietseigenes Saat- und Pflanzgut ausgebracht werden darf (Fischer-Hüftle 2018, Holljesiefken 2007, Schumacher & Schumacher 2020). Diese Vorgabe zielt darauf ab sicherzustellen, dass regionale Genpools für die Biodiversität, die Grünfutterproduktion (Oehri 2020, Offenberger 2020), die Ernährungssicherung (Schwand et al. 2009), die Klimaanpassung (Alsos et al. 2012, Franks & Hoffmann 2012, Schleuning et al. 2016) und entsprechend internationaler Verpflichtungen (z.B. CBD 1992) erhalten bleiben.
So ist fachlich unstrittig, dass im Wesentlichen heimische Pflanzenarten in der Lage sind, die Artenvielfalt zu erhalten, da nur sie von speziell angepassten Insektenarten genutzt werden können (Abrahamczyk et al. 2020). Zahlreiche Schmetterlinge und ein Großteil der heimischen Wildbienen sind allein auf eine einzige Pflanzenfamilie, eine einzige Gattung oder sogar an eine einzige Art als Futterpflanze angepasst und werden als oligolektisch bezeichnet. Genauso sind monophage Zikaden, Käfer oder Schmetterlingsraupen nur an eine Pflanzenart als Nahrung angepasst. Daher sollte überall in Blühmischungen, also auch innerörtlich, möglichst auf fremdländische Arten verzichtet werden, da diese früher oder später auch die freie Landschaft erreichen können (Abb. 5). Fremdländische Arten tragen, neben der mangelnden Nutzbarkeit für Insekten, auch eine vorab kaum abschätzbare potenzielle Gefahr in sich, sich als invasive Neophyten zu etablieren (Bosshard et al. 2015). Aber auch innerhalb der heimischen Pflanzenarten finden sich oft deutliche genetische Unterschiede (Durka et al. 2016, 2019), weshalb zum Schutz der genetischen Vielfalt nur regionale (= gebietseigene) Herkünfte verwendet werden sollten (Abb. 5).
So kann die Ansaat von Pflanzenbeständen mit nicht gebietseigenem Saatgut vor allem auf der genetischen Ebene erhebliche Konsequenzen für die vor Ort bereits existierenden Pflanzenpopulationen nach sich ziehen (Kaulfuß & Reisch 2019, Mc Kay et al. 2005, Seitz & Kowarik 2003). Die Variationsbreite der Arten hängt von der Landschaftsstruktur ab, die den Genfluss zwischen Populationen und damit sowohl das Ausmaß genetischer Diversität als auch den Umfang genetischer Differenzierung steuert (Reisch et al. 2017, Slatkin 1987). Darüber hinaus spielen auch die Umweltbedingungen und die spezifische Anpassung der Pflanzen an diese Bedingungen eine wichtige Rolle für die genetische Variation (Bucharova et al. 2017): Jede Pflanzenart weist in einem bestimmten geographischen Bezugsrahmen ein spezifisches genetisches Muster auf, das durch eingebrachtes nicht-gebietseigenes Pflanzenmaterial irreversibel verfälscht werden kann (Kaulfuß & Reisch 2017). Regionale Sippen oder Ökotypen können durch die Vermischung verloren gehen, was einen Verlust an genetischer Vielfalt bedeutet und als „genetic swamping“ bezeichnet wird (Balao et al. 2015, Maschinski et al. 2010).
Normalerweise sind die Gene einer Pflanze entsprechend den lokalen Umweltbedingungen sehr genau aufeinander abgestimmt – man spricht von koadaptierten Genkomplexen (Frankham et al. 2002). Durch die Vermischung unterschiedlicher Herkünfte können diese Genkomplexe aufgebrochen werden, sodass die aus der Kreuzung hervorgehenden Individuen nicht mehr optimal an die jeweiligen Umweltbedingungen angepasst sind, was als „outbreeding depression“ bezeichnet wird (Keller et al. 2000, van der Mijnsbrugge 2010) und zum Beispiel in einer geringeren Keimfähigkeit der Samen zum Ausdruck kommen kann. Dies kann das Überleben gerade von kleinen Populationen gefährden.
Von besonderer Bedeutung ist auch die Phänologie, also die zeitliche Entwicklung der Pflanzenindividuen oder Populationen (Buisson et al. 2017). Diese hängt stark von den Umweltbedingungen und dabei insbesondere vom Klima (Stinchcombe et al. 2004) sowie der Landnutzung ab (Reisch & Poschlod 2009, Völler et al. 2017). Je nach Umweltbedingungen blühen und fruchten Pflanzen zu unterschiedlichen Zeiten, die optimal auf die jeweiligen Bedingungen im Habitat abgestimmt sind. Durch die Einkreuzung von Individuen mit abweichender Blührhythmik kann sich die Phänologie der Pflanzen so ändern, dass sie nicht mehr zur Phänologie der Bestäuber, dem Klima oder der Nutzung passt, was weitreichende Folgen für das gesamte Ökosystem haben kann (Bucharova et al. 2017, Elzinga et al. 2007). Eine mögliche Folge ist zudem, dass an die Pflanzen gekoppelte Phytophagen-, Parasiten- und Hyperparasiten-Komplexe zusammenbrechen, was bislang allerdings nahezu nicht untersucht ist. Einen ersten Eindruck vermittelt das Beispiel, dass in Blühmischungen öfter anstelle Lotus corniculatus var. corniculatus die größer und schneller wachsende Varietät L. c. var. sativus zu finden ist. Dieser fehlen einige Inhaltsstoffe, weshalb man auf ihr weder parasitierende Individuen von Orobanche gracilis noch Bläulinge findet (A. Fleischmann mündliche Mitteilung).
Zudem kann man sowohl bei Gräsern/Kräutern (Krautzer et al. 2007) als auch bei Gehölzen deutlich bessere Etablierungsraten bei gebietseigenem Material feststellen (Bloemer 2016, Kiehl et al. 2010, Seitz & Kowarik 2003). Daher sollte gebietseigenes (oder gar autochthones) Material im Naturschutz grundsätzlich das Mittel der Wahl sein, beispielsweise bei Neuanlage, Wiederherstellung oder der Aufwertung artenreichen Grünlandes (Auestad et al. 2016, Baasch et al. 2016).
4 Acht Schritte, um Insekten mit blühenden Wiesen zu fördern
Vor dieser Ausgangslage und vielen Unklarheiten zur Anlage von Blühflächen möchten wir im Folgenden vorstellen, wie es in wenigen Abwägungsschritten gelingen kann, effizient und vielfach kostengünstig, wirklich wertvolle Lebensräume für heimische Insekten – auch für seltene – zu schaffen.
Schritt 1: Entwickeln vor Ansäen: Analyse, ob Landschaftspflege oder Bewirtschaftung optimiert werden können
Durch die oft irreführenden Empfehlungen zu Blühmischungen werden von Kommunen, Verbänden und Privatpersonen öfter Freiflächen umgebrochen und neu angesät. Leider werden so teilweise auch Flächen mit reichhaltiger, einheimischer Artenausstattung oder Bodensamenbank zerstört; etwa mehrjährige Ruderalflächen, alte Rasenflächen oder artenreiche Säume. Dabei sind gerade diese Flächen oft von herausragender Bedeutung für seltene und spezialisierte Insektenarten (Westrich 1990). Daher sollte unbedingt vor jedem Einsatz von Ansaaten von einer fachkundigen Person geprüft werden, ob nicht durch eine optimierte Bewirtschaftung der betreffenden Flächen mehr für den Artenschutz erreicht werden kann als durch Umbruch oder gar Austausch des Bodens und Ansaat einer Blühmischung.
Erfolgversprechende Ansätze zur naturschutzfachlichen Aufwertung sind beispielsweise:
- Mulchen auf Mahd mit Abfuhr umstellen, vor allem im kommunalen Bereich;
- Extensive Mahd (die Methoden sind hinlänglich bekannt): später und seltener mähen, keine Aufbereiter verwenden, Messerbalken statt Kreiselmäher verwenden (zum Beispiel Gyimóthy 2019, van de Poel & Zehm 2014);
- Altgrasstreifen belassen, Wanderbrachen im Umfang von bis zu 20 % der Fläche (van de Poel & Zehm 2014);
- keine oder reduzierte Düngung; wenn Düngung, dann mit Festmist statt mit Gülle oder Mineraldünger, vor allem wegen der geringeren Nitratauswaschung von Festmist (LfL 2003);
- auf nährstoffarmen Äckern und Ackerrändern anstatt Grünlandansaat oder Blühstreifen extensiven Ackerbau ohne Pflanzenschutzmittel anstreben, zum Schutz heimischer Ackerwildkräuter und der an sie gebundenen Insektenfauna (Ackerrandstreifenprogramm oder AUKM „Extensive Ackerbewirtschaftung“ und ähnliche Programme). Auch zeitweilige Brachlegung vor allem von nährstoffarmen Äckern kann viel Nahrung und Lebensraum für Insekten bieten (Tscharntke et al. 1996).
Details zu diesen Ansätzen sind vielfach und umfangreich in der Fachliteratur beschrieben und in den Agrarumweltprogrammen hinterlegt, detaillierte Ausführungen dazu würden den Rahmen dieses Artikels sprengen.
Schritt 2: Selbstbegrünung
Kann ein optimiertes Management allein eine Fläche nicht verbessern, kann durch oberflächliches Auflockern mit anschließender Selbstbegrünung das Samenpotenzial im Boden aktiviert oder die Einwanderung aus der Umgebung erleichtert werden (Auestad et al. 2016, Ruprecht et al. 2010). Bei Bedarf kann auch mit moderater Nachsaat gebietseigenen Saatguts gearbeitet werden. Somit werden zudem frühe Sukzessionsstadien geschaffen, wie sie in der Kulturlandschaft vielfach unterrepräsentiert sind. Es können sich zeitweilig Therophyten- oder Ruderalfluren etablieren, die artenreich sein können, lange vegetativ nicht mehr beobachteten Pflanzenarten Lebensraum bieten (Ruprecht et al. 2010) und bei sonniger Lage zudem als Brutplätze für bis zu 2/3 der heimischen Wildbienenarten fungieren können (Radtke 2019). Daher sollten mindestens kleinflächig Stellen für eine Selbstbegrünung in Wiederherstellungsflächen integriert werden.
Schritt 3: Standort für die Neuanlage auswählen
Ist eine Neuanlage von dauerhaft artenreichen Wiesen geplant, muss ein passender Standort gefunden werden. Sonderstandorte wie trockenwarme oder feuchte Säume – gerade im Übergangsbereich von Wald und Offenland – aber auch alte Lebensräume sollten möglichst immer durch verbesserte Pflege optimiert werden (vergleiche Schritt 1). An diesen Stellen kann eine gut gemeinte Maßnahme wesentlich zum Verlust letzter Lebensräume heimischer Arten beitragen. Neuanlagen sollten sich auf mittlere, bislang intensiv genutzte Flächen konzentrieren.
Im Einzelfall geprüft werden sollte eine Anlage von Blühflächen oder -streifen dicht neben stark befahrenen Straßen, die dann neben Insekten auch Vögel und Eidechsen anziehen, welche durch den Straßenverkehr hohe Verluste erleiden können. Für sehr viele Insektenpopulationen sind die Individuenverluste dagegen zumeist wenig bedeutsam, da die meisten Arten über hohe Vermehrungsraten verfügen und eher durch den Mangel an Lebensraum limitiert sind (A. Segerer mündliche Mitteilung).
Gerade auch für temporäre Blühflächen und -streifen auf Äckern sind Standort und Umgebung bedeutsam. Für Insekten können vor allem Blühstreifen kritisch sein, die in einer intensiv genutzten (Acker-)Landschaft angelegt werden, speziell wenn die Streifen schmal sind und bei der Anwendung von Pestiziden keine ausreichenden Abstände eingehalten werden, bei Wind gespritzt wird oder die verfügbaren Minderungstechniken, zum Beispiel sogenannte Randdüsen oder Drop-leg-Verfahren, nicht konsequent angewandt werden, um eine Verdriftung in die Randstrukturen wirksam zu mindern (Fluhr-Meyer & Adelmann 2020).
Blühflächen können wenig wirksam für den Insektenschutz sein oder sogar schaden, wenn sie durch direktes Überspritzen, die Verdriftung von Pflanzenschutzmitteln (vor allem längerfristig wirksamer Insektizide) in die Blühstreifen und fehlende Bruthabitate geprägt sind. Solche Maßnahmen können sogar als ökologische Fallen (Hale & Swearer 2016) wirken, die Insekten aus der Umgebung anlocken, welche dann durch Insektizidaufnahme geschädigt werden können (Botias et al. 2015, 2016, David et al. 2016, Fluhr-Meyer & Adelmann 2020, Linhard 2018). Daher müssen auf vorher mit Insektiziden behandelten Flächen die vorgegebenen Abstandszeiten berücksichtigt werden und die Streifen nach Brühl et al. (2015) eine Breite von wenigstens 6–8 m haben, um Insekten wirklich zu nützen. Der Spritzabstand muss mindestens 20 m betragen.
Schritt 4: Regionale Übertragung von Samen geeigneter Spenderflächen
Zur Neuanlage artenreicher, dauerhafter Wiesen bieten sich in erster Linie Übertragungsverfahren an (Buchwald et al. 2011, Zahlheimer 2013). Ein Übertrag von artenreichen Spenderwiesen der näheren Umgebung oder zumindest des gleichen Naturraums verspricht eine hohe naturschutzfachliche Erfolgswahrscheinlichkeit (Bloemer 2016, Braun 2016, Zahlheimer 2013).
So sind zahlreiche effiziente Übertragmöglichkeiten in der Praxis erprobt (zum Beispiel Bosshard et al. 2015, von Brackel 2010, FLL 2014, Heinz & Rupp 2018, Kiehl et al. 2010, LfU 2020, Natürlich Bayern 2020a), die teilweise günstiger sind als gekauftes Saatgut. Neben sommerlichem Mahdgutübertrag bietet sich ganzjährig ein Sodenübertrag oder ein herbstlicher Rechguttransfer an, der – richtig eingesetzt – sogar noch dazu dienen kann, die Vegetationsstruktur der Spenderfläche zu verbessern. Sehr gute Ergebnisse liefert zudem eine Aussaat von Samen, die mittels Wiesendrusch, Heudrusch®oder Ausbürstmaterial (zum Beispiel mit „eBeetle®“ oder „Wiesefix“) geerntet wurden. Übertragverfahren können – im Gegensatz zu allen Ansaatverfahren – neben Samen auch Pilze und Individuen der typischen Fauna mit übertragen (Braun 2006, Buchwald et al. 2011, Elias & Thiede 2008), beispielsweise in Pflanzen oder Boden abgelegte Eier von Käfern, Heuschrecken oder verschiedene Spinnentiere. Übertrag – oder eine Einbindung neuer Flächen in Huteweiden – kann auch genutzt werden, um bestehendes oder angesätes Grünland mit Pflanzenarten anzureichern (Baasch et al. 2016, Edwards et al. 2007, Helm & Schiffgens 2020, Schmiede et al. 2012). Vor einer Ernte muss Kontakt zur Unteren Naturschutzbehörde aufgenommen werden, da entsprechend § 39 BNatschG eine kommerzielle Entnahme genehmigungspflichtig ist und um Konflikte zum Gebiets- oder Artenschutz auszuschließen (LfU 2020). Übertragungsverfahren sollten nur für langfristig angelegte Begrünungen verwendet werden, damit nicht wertvolles Spendermaterial für kurzfristige Maßnahmen verloren geht.
Schritt 5: Passendes Saatgut auswählen
Falls Übertragungsverfahren ausscheiden, kommt als nächste Option für dauerhaft anzulegende Flächen eine Ansaat in Betracht, wofür es zertifizierte Mischungen, sogenanntes Regiosaatgut, für Wiesen, Wegränder, Gewässer- und Gehölzsäume gibt. In Deutschland sind dafür bisher zwei Zertifizierungen zugelassen (RegioZert 2020, VWW 2020), die neben zwei bundesweit agierenden Saatguterzeugern auch einige regionale Hersteller umfassen. Allerdings ist für viele Regionen bisher kein oder kaum gebietseigenes Saatgut erhältlich (Schenkenberger 2020). Künftig sollten daher Initiativen gestartet werden, um in naher Zukunft eine flächendeckende Verfügbarkeit von Regiosaatgut sicherzustellen, wenn dies durch bisherige Saatgutanbieter nicht geleistet werden kann.
Aufgrund des Lieferengpasses ist derzeit zu empfehlen, flexibel auf mangelnde Artenverfügbarkeiten zu reagieren und auf einzelne, nicht lieferbare Arten zu verzichten, Alternativarten zu ergänzen und notfalls durch eine begrenzte Menge kurzlebiger „Platzhalter“ (Kulturarten) aufzustocken. Aus fachlicher Sicht ist der Einsatz von Kulturpflanzen oder Zwischenbegrünungen weniger kritisch als gebietsfremde Herkünfte heimischer Arten. Zwischenbegrünungen können im Rahmen der Narbenerneuerung später ausgetauscht werden. Alternativ kann durch gezielte Handernte in geeigneten Spenderflächen auch versucht werden, die Vegetation anzureichern (Helm & Schiffgens 2020). Gegebenenfalls erfolgende Zumischungen aus angrenzenden Ursprungsgebieten sollten auf maximal 10 % des Gesamtgewichtes oder maximal fünf Arten begrenzt werden; dann allerdings muss die Ausbringung von den Naturschutzbehörden genehmigt werden. Eine Beimischung von nicht gebietseigenem Regelsaatgut muss unbedingt unterbleiben. Im Einzelfall sollte auch geprüft werden, ob die Ansaat nicht bis zu dem Zeitpunkt aufgeschoben werden kann, zu dem gebietseigenes Saatgut verfügbar ist. Je nach Ausgangssituation können so wertvolle Ruderalflächen entstehen.
Ergänzend zu Wiesenmischungen können auch einjährige heimische Arten wie zum Beispiel Cyanus segetum , Papaver rhoeas , Bromus secalinus oder Secale cereale als „Ammenpflanzen“ zur Bodenbefestigung oder für einen schnellen Blüheffekt beigemischt werden (Abb. 6). Diese werden nach wenigen Jahren durch die konkurrenzstärkeren mehrjährigen Pflanzen der Mischung oder durch einwandernde Arten ersetzt. Dabei sind bereits mittelfristig gebietseigene Mischungen ökonomisch effizienter, da sie einen dauerhaften Erosionsschutz bieten (Bloemer 2016, Bosshard et al. 2015).
Bei dauerhaften Ansaaten für Naturschutzzwecke ist zertifiziertes Regiosaatgut als Mindeststandard vorzusehen (Kiehl et al. 2010) und erfüllt auch die gesetzlichen Vorgaben des § 40 Abs. 1 BNatSchG. Damit ist gewährleistet, dass neben gebietsfremden und exotischen Arten auch (invasive) Neophyten fehlen. Selbst zusammengestellte Samenmischungen sollten nach unserer Einschätzung rund 20 bis 30 (40) Wildkräuter und sechs bis acht konkurrenzschwächere Gräser (zum Beispiel Helictotrichon pubescens , Anthoxanthum odoratum oder Briza media ) enthalten, um eine ausgewogene Entwicklung dauerhaft artenreicher Bestände zu fördern.
Schritt 6: Bodenbereitung und Anlagedesign
Über die Frage, ob zum Beispiel artenreiches Grünland oder gar Magerrasen entstehen kann, entscheiden letztendlich die Boden- und Klimabedingungen (wie Chemismus, Exposition und Hangneigung; zum Beispiel Buchwald et al. 2011). So dürfen anfallende Rohböden für artenreiche Wiesen nicht humusiert (das heißt mit Humusschicht abgedeckt) oder mit Kompost angereichert werden (Bosshard et al. 2015). Bodenunebenheiten und anstehende Felsen sollten für eine möglichst große Standortvielfalt erhalten werden, wobei auf maschinelle Bewirtschaftbarkeit geachtet werden sollte. Krautzer et al. (2007) konnten beispielhaft zeigen, dass sich auf humusierten Böden in kurzer Zeit vor allem grasartige Pflanzen durchsetzen. Dadurch kann eine Artenvielfalt erst gar nicht entstehen, da sich viele der gesäten Arten nicht ansiedeln können und einheimische Arten vom Einwandern abgehalten werden. Im Vorfeld zur Ansaat muss die Grasnarbe weitgehend aufgelöst werden (Kiehl et al. 2010, Kirmer et al. 2014). Ein Abschieben oder ein kompletter Austausch des Oberbodens sollte aber nur bei stark überdüngtem oder mit Schadstoffen belastetem Boden stattfinden (Buchwald et al. 2011). Sollte Substrat eingebracht werden, sollte Tiefenboden (nährstoffarm, diasporenfrei) aus der Region oder innerörtlich ein Feinkies- oder Sand-Kompost-Gemisch (Verhältnis 4:1) verwendet werden. Ein beigemischter Kompost sollte hygienisiert – also frei von keimfähigen Unkrautsamen – sein (Natürlich Bayern 2020b).
Um mit temporären Blühflächen auf Äckern wirklich positive Effekte auf die Individuen- und vor allem Artenzahl von Wildinsekten zu erzielen, müssen diese als Strukturmosaike angelegt werden (vergleiche Buhk et al. 2018). Dies benötigt unterschiedliche Mischungen, differenzierte Saatzeitpunkte, durch geringere Saatstärke lichtwüchsige Abschnitte wie auch dichtere Teilflächen mit mindestens 10 % Anteil in einem größeren Landschaftsraum. Damit können beispielsweise Rebhuhn, Wachtel, Feldlerche und Feldhase gefördert werden. Wiederum sollte an kleine Selbstbegrünungsflächen gedacht werden, als auch geprüft werden, ob Offenboden, Bienenhügel und zusätzliche Strukturen wie zum Beispiel Asthaufen ergänzt werden können.
Schritt 7: Auf Insektenerhalt ausgerichtetes Management
Ist der Konkurrenzdruck auf die angesäten Arten durch starkes Aufkommen von unerwünschten Pflanzen wieCirsium arvense ,Chenopodium -,Atriplex - oderRumex -Arten zu groß, kann etwa acht Wochen nach der Aussaat ein nicht zu tiefer Schröpfschnitt erfolgen (mindestens 10 cm Höhe). Dieser kann bei Bedarf wiederholt werden. Ziel sollte ein wiesenartiger Bestand sein, der langfristig durch angepasste Nutzung oder Pflege in eine artenreiche, naturnahe und stabile Artenkombination überführt wird (Bosshard et al. 2015). Daher sollte nach einer Anwuchsphase regelmäßig gemäht und das Mahdgut möglichst immer entfernt werden (Kirmer et al. 2014). Mulchen ist außer auf ganz armen Standorten naturschutzfachlich abzulehnen, da es zu Streuakkumulation, Verfilzung und einer Selektion auf wenige, zu vegetativer Vermehrung fähiger Arten führt (Kempf 1981, Schreiber 1991). Zudem macht Mulchen durch eine kontinuierliche Nährstoffakkumulation häufigere Pflegedurchgänge erforderlich. Ist Mulchen unvermeidlich, sollte das Mulchgut immer entfernt werden; selbst Absaugen ist gegenüber Liegenlassen zu präferieren. Um die stark von den Standorten und der Region abhängige Mahdfrequenz sowie die Schnittzeitpunkte festzulegen, sollten gegebenenfalls Experten hinzugezogen werden.
Bei jeder Mahd sollten Teilflächen (zum Beispiel Streifen einer Arbeitsbreite, maximal 20 % der Fläche) stehen gelassen werden (Kirmer et al. 2014, van de Poel & Zehm 2014), um Tieren jederzeit Nahrung oder Verstecke in Altgrasstreifen zu bieten. Diese Flächen müssen aber bei der nächsten Mahd wieder genutzt werden (Wanderbrachen/Altgrasstreifen). Düngung sollte vermieden oder moderat durchgeführt werden; Festmist ist dabei ganz deutlich der Vorrang zu geben.
Schritt 8: Öffentlichkeitsarbeit
Vor allem innerorts werden extensiv gepflegte, spät oder selten gemähte Flächen sowie Ruderalflächen von der Bevölkerung oft als „unordentlich“ wahrgenommen; Beschwerden im Rathaus sind nach Mitteilungen von Bürgermeistern eine regelmäßige Folge. Die Erfahrung hat gezeigt, dass das Aufstellen von Schildern oder kurze Presseartikel mit fachlich fundierten, aber leicht verständlichen Erklärungen zum Sinn der Maßnahme sehr hilfreich sind oder gar zu positiven Rückmeldungen von den Bürgern führen. Daher sollte Öffentlichkeitsarbeit Teil einer jeden Neuanlage sein. Allerdings entbindet eine Beschilderung nicht von einer kontinuierlichen Betreuung der Fläche und einem ggf. zeitnahen Eingreifen, wenn Fehlentwicklungen oder Vermüllung zu beobachten sind.
Dank
Wir danken Prof. Dr. Christoph Reisch von der Universität Regensburg für wichtige Beiträge zu den genetischen Aspekten der Florenverfälschung.
Literatur
Abrahamczyk, S., Wohlgemuth, T., Nobis, M. et al. (2020): Shifts in food plant abundance for flowervisiting insects between 1900 and 2017 in the canton of Zurich, Switzerland, Ecological Applications 00(00):e02138. 10.1002/eap.2138. Albrecht, M., Kleijn, D., Williams, N.M. et al. (2020): The effectiveness of flower strips and hedgerows on pest control, pollination services an crop yield: a quantitative synthesis. Ecol. Letters 23: 1488-1498. Alsos, I., Ehrich, D., Thuiller, W. et al. (2012): Genetic consequences of climate change for northern plants. Proc. Biolog. sc./The Royal Soc. 279, 2042-2051. 10.1098/rspb.2011.2363. Auestad, I., Rydgren, K., Austad, I. (2016): Near-natural methods promote restoration of species-rich grassland vegetation – revisiting a road verge trial after 9 years. Restor. Ecol. 24 (3), 381-389. Baasch, A., Engst, K., Schmiede, R. et al. (2016) Enhancing success in grassland restoration by adding regionally propagated target species. Ecol. Engineering 94, 583-591. Balao, F., Casimiro-Soriguer, R., García-Castaño, J.L. et al. (2015): Big thistle eats the little thistle: does unidirectional introgressive hybridization endanger the conservation of Onopordum hinojense? New Phytol. 206, 448-458. BfN (Bundesamt für Naturschutz; 2017): Agrar-Report 2017. Bonn-Bad Godesberg.
Bennett, J.M. Steets, J.A., Burns, J.H. et al. (2020): Land use and pollinator dependency drives global patterns of pollen limitation in the Anthropocene. Nature Communications 11: 3999, DOI: 10.1038/s41467-020-17751-y.
Biesmeijer, J.C., Roberts, S.P.M., Reemer, M. et al. (2006): Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science 313 (5785), 351-354.
Bloemer, S. (2016): Begrünungen mit Regiosaatgut und naturraumtreuem Saatgut aus Sicht der Praxis. Straße und Autobahn 11, 903-913.
Bosshard, A., Mayer, P., Mosimann, A. (2015): Leitfaden für naturgemässe Begrünungen in der Schweiz. Ökol. u. Landschaft, 82 S., Oberwil-Lieli.
Botías C., David., A., Hill, E.M., Goulson, D. (2016): Contamination of wild plants near neonicotinoid seed-treated crops, and implications for non-target insects. Sci. Total Envir., 269-278.
–., David, A., Horwood, J. et al. (2015): Neonicotinoid residues in wildflowers, a potential route of chronic exposure for bees. Environ. Sci. Technol. 49, 12731-12740.
Braun, T. (2016): Artenreiches Grünland durch Mahdgutübertragung. Natur in NRW 4, 18-21.
Breeze, T.D., Bailey, A.P., Balcombe, K.G., Potts, S.G. (2011): Pollination services in UK: how important are honeybees? Agr, Ecosyst. Environ. 142 (3-4), 137-143.
Brühl, C., Alscher, A., Hahn, M. et al. (2015): Protection of Biodiversity in the Risk Assessment and Risk Management of Pesticides (Plant Protection Products & Biocides) with a Focus on Arthropods, Soil Organisms and Amphibians. – Federal Environment Agency, Texte 76/2015.
Buch, C., Jagel, A. (2019): Schmetterlingswiese, Bienenschmaus und Hummelmagnet – Insektenrettung aus der Samentüte? Veröff. Bochumer Bot. Ver. 11 (2), 9-24.
Bucharova, A., Michalski, S., Hermann, J.-M. et al. (2017): Genetic differentiation and regional adaptation among seed origins used for grassland restoration: lessons from a multispecies transplant experiment. J. Appl. Ecol. 54, 127-136.
Buchwald, R., Rosskamp, T., Steiner, L., Willen, M. (2011): Wiederherstellung und Neuschaffung artenreicher Mähwiesen durch Mähgut-Aufbringung – ein Beitrag zum Naturschutz in intensiv genutzten Landschaften. Abschlussber., Univ. Oldenburg, 185 S.
Buhk, C., Oppermann, R., Scharnowski, A. et al. (2018): Flower strip networks offer promising long term effects on pollinator species richness in intensively cultivated agricultural areas. BMC Ecology 18, 55, 1-13.
Buisson, E., Alvarado, S.T., Stradic, S., Morellato, L.P.C. (2017): Plant phenological research enhances ecological restoration. Restor. Ecol. 25, 164-171.
Bundesinformationszentrum Landwirtschaft (2020): Insektensterben in Deutschland. www.landwirtschaft.de/diskussion-und-dialog/umwelt/insektensterben-in-deutschland, (Abruf Mai 2020).
Burkle, L.A., Marlin, J.C., Knight, T.M. (2013): Plant-Pollinator Interactions over 120 Years: Loss of Species, Co-Occurrence, and Function. Science 339 (6127), 1611-1615.
CBD (Convention on Biological Diversity; 1992): www.cbd.int/convention/text/.
David, A., Botías, C., Alaa, A.-S. et al. (2016): Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environm. Intern. 88, 169-178.
DGfE (Deutsche Gesellschaft für Entomologie; 2016): Resolution zum Schutz der mitteleuropäischen Insektenfauna. Naturschutz u. Landschaftspl. 48 (12), 393-394.
Dieterich, M., Heintschel, S., Hausberg, M. et al. (2016): Biomassekulturen der Zukunft aus Naturschutzsicht (…), BfNSkripten 442, 328 S.
Dietzel, S., Sauter, F., Moosner, M. et al. (2019): Blühstreifen und Blühflächen in der landwirtschaftlichen Praxis – eine naturschutzfachliche Evaluation. ANLiegen Natur 41 (1), 73-86.
Durka, W., Bossdorf, O., Bucharova, A. et al. (2019): Regionales Saatgut von Wiesenpflanzen: genetische Unterschiede, regionale Anpassung und Interaktion mit Insekten. Natur und Landschaft 94 (4), 146-153.
–, Michalski, S.G., Berendzen, K.W. et al. (2016): Genetic differentiation within multiple common grassland plants supports seed transfer zones for ecological restoration. J. App. Ecol.; DOI: 10.1111/1365-2664.12636.
Edwards, A.R., Mortimer, S.R., Lawson, C.S. (2007): Hay strewing, brush harvesting of seed and soil disturbance as tools for the enhancement of botanical diversity in grasslands. Biol. Cons. 134, 372-382.
Ekroos, J., Kleijn, D., Batáry, P. et al. (2020): High land-use intensity in grasslands constrains wild bee species richness in Europe. Biol. Cons. 241, 1-8.
Elias, D., Thiede, S. (2008): Transfer of grasshoppers (Insecta: Ensifera et Caelifera) with fresh mowing material in the Wulfener Bruch (Saxony-Anhalt). – Hercynia 41, 253-262.
Elzinga, J.A., Atlan, A., Biere, A. et al. (2007): Time after time: flowering phenology and biotic interactions. Trends Ecol. & Evol. 22, 432-439.
EuRH (Europäischer Rechnungshof; 2020): Schutz wilder Bestäuber in der EU — Initiativen der Kommission haben keine Früchte getragen. Sonderbericht 15, 70 S.
Fischer-Hüftle, P. (2018): Rechtliche Anforderungen an die Auswahl des Saatguts auf Blühflächen und Blühstreifen. ANLiegen Natur 40 (2), 113-116.
FLL e.V. (2014): Empfehlungen für Begrünungen mit gebietseigenem Saatgut. https://shop.fll.de/de/produktion-guetebest/gebietseigenes-saatgut-2014- download.html.
Fluhr-Meyer, G., Adelmann, W. (2020): Blühstreifen und Pestizide – Falle oder Lebensraum? ANLiegen Natur 42 (2).
Frankham, R., Ballou, J.D., Briscoe, D.A. (2002): Introduction to Conservation Genetics. Cambridge Univ. Press.
Franks, S., Hoffmann, A. (2012): Genetics of Climate Change Adaptation. Annual review of genetics 46. 10.1146/annurev-genet-110711-155511.
Gatter, W., Ebenhöh, H., Kima, R. et al. (2020): 50-jährige Untersuchungen an migrierenden Schwebfliegen, Waffenfliegen und Schlupfwespen belegen extreme Rückgänge (…). Entom. Zeitschr. 130(3), 131-142.
Gyimóthy, A. (2019): Landschaftspflegegras – Energetische Verwertung und Artenschutz. In: Heiland, S. (Hrsg.): Klima- und Naturschutz: Hand in Hand, Berlin.
Haaland, C., Naisbit, R., Bersier, L.F. (2011): Sown wildflower strips for insect conservation: a review. Insect Cons. Div. 4, 60-80.
Hale, R., Swearer, S. (2016). Ecological traps: Current evidence and future directions. Proc. Royal Soc. B: Biolog. Sc. 283. 20152647.
Hallmann, C., Sorg, M., Jongejans, E. et al. (2017): More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PLoS ONE 12 (10), e0185809.
Heinz, S., Rupp, F. (2018): Transfer – Artenanreicherung im Wirtschaftsgrünland. – LfLInformation, Bayer. Landesanst. f. Landwirtschaft.
Helm, S., Schiffgens, T. (2020): Mahdgutübertragung zur Entwicklung artenreicher Wiesen. – Natur in NRW 3, 11-15.
Holljesiefken (2007): Die rechtliche Regulierung invasiver gebietsfremder Arten in Deutschland. Schriftenr. Natur und Recht 8, 389 S.
Kaulfuß, F., Reisch, C. (2017): Reintroduction of the endangered and endemic plant species Cochlearia bavarica – Implications from conservation genetics. Ecol. & Evol. 7, 11100- 11112.
–, Reisch, C. (2019): Restoration of grasslands using commercially produced seed mixtures: genetic variation within and among natural and restored populations of three common grassland species. Cons. Genetics 20, 373-384.
Keller M., Kollmann J., Edwards P.J. (2000): Genetic introgression from distant provenances reduces fitness in local weed populations. J. Appl. Ecol. 37, 647-659.
Kempf, H. (1981): Erfahrungen mit verschiedenen Pflegemethoden im Naturschutzgebiet „Harzgrund“ bei Suhl. Landschaftspf. u. Naturschutz Thüringen, 12-17.
Kiehl, K, Kirmer, A., Donath, T.W. (2010): Species introduction in restoration projects – Evaluation of different techniques for the establishment of semi-natural grasslands in Central and Northwestern Europe. Basic App. Ecol. 11: 285-299.
Kirmer, A., Jeschke, D., Kiehl, K., Tischew, S. (2014): Praxisleitfaden zur Etablierung und Aufwertung von Säumen und Feldrainen. Hochschulen Anhalt & Osnabrück, 70 S.
Kleijn, D., Baquero, R.A., Clough, Y. et al. (2006): Mixed biodiversity benefits of agrienvironment schemes in five European countries. Ecol. Letters 9, 243-254.
–, Sutherland, W. J. (2003): How effective are European agri-environment schemes in conserving and promoting biodiversity? J. Appl. Ecol. 40, 947-969.
Krautzer, B., Graiss, W., Blaschka, A. (2007): Standortgerechte Wiederbegrünung im Straßenbau. Projektber.: 20.S.; Raumberg-Gumpenstein.
Langgemach, T., Ryslavy, T., Jurke, M. et al. (2019): Vogelarten der Agrarlandschaft in Brandenburg – Bestände, Bestandstrends, Ursachen aktueller und langfristiger Entwicklungen und Möglichkeiten für Verbesserungen. – Natursch. u. Landschaftspf. Brandenburg 28 (2,3), 4-68.
LfL (Bayerische Landesanstalt für Landwirtschaft; 2003): Vergleich der Wirkung von Gülle mit Stallmist und Jauche im Ökologischen Landbau. Beratungsunterlagen f. d. ökolog. Landbau.
– (2020): www.lfl.bayern.de/iab/kulturlandschaft/030381/.
LfU (Bayerisches Landesamt für Umwelt; 2020): www.lfu.bayern.de/natur/regionaler_artentransfer/artentransfer_uebertragungsverfah ren/. Linhard, D. (2018): Pestizidtest: Ackerrandstreifen. GLOBAL 2000, 13 S., Wien.
Mandery, K., Müller, M. (2019): Untersuchung zur Bedeutung von Randstrukturen als Nisthabitate für Wildbienen im Zusammenhang mit Blühflächen. Unveröff. Ber. i. A. BUND Naturschutz Bayern, 1-25.
–, Müller, M., Zeisel, J. (2018): Wildbienen auf Äckern mit Blühmischungen. Unveröff. Studie i. A. BUND Naturschutz Bayern.
Maschinski, J., Sirkin, E., Fant, J. (2010): Using genetic and morphological analysis to distinguish endangered taxa from their hybrids with the cultivated exotic pest plant Lantana strigocamara (syn: Lantana camara). Cons. Genetics 11, 1607-1621.
McKay, J.R., Christian, C.E., Harrison, S., Rice, K.J. (2005): „How local is local?“ – a review of practical and conceptual issues in the genetics of restoration. Restor. Ecol. 13, 432440.
Natürlich Bayern (2020a): www.natuerlichbayern.de. – (2020b): www.natuerlichbayern.de/fileadmin/user_upload/Publikationen/HandbuchA4_2020_web.pdf.
Nuß, M. (2016): Der stumme Frühling – von der Fiktion zur Wirklichkeit. Sächs. Naturschutztag, 22-32.
Nyffeler, M., Bonte, D. (2020): Where have all the spiders gone? Observations of a dramatic population density decline in the once very abundant Garden Spider, Araneus diadematus (...). Insects 11, 248, DOI: 10.3390/insects11040248, 12 pp.
Oehri, J., Schmid, B., Schaepman-Strub, G., Niklaus, P.A. (2020): Terrestrial land-cover type richness is positively linked to landscape-level functioning. Nature Comm. 11, 154; DOI: 10.1038/s41467-019-14002-7.
Offenberger, M. (2020): Ökosystemforschung: Pflanzenvielfalt fördert Stabilität von Nahrungsnetzen. ANLiegen Natur 42 (1), 91-98.
Oppermann, R., Buhk, C., Pfister, S. (2019): Handlungsperspektiven für eine insektenfreundliche Landnutzung. Natur und Landschaft 94 (6/7), 279-288.
–, Haider, M., Kronenbitter, J. et al. (2013): Blühflächen in der Agrarlandschaft (…). Ber. zu wiss. Begleitunters. des Projekts Syngenta Bienenweide, 191 S. Poschlod, P. (2015): Geschichte der Kulturlandschaft. Ulmer. 320 S.
Radtke, M. (2019): Gefährdete Wildbienen – Nisthilfen bauen und Lebensräume schaffen. BUND KG Rotenburg, 24 S.
RegioZert (2020): www.bdp-online.de/de/Branche/Saatguthandel/RegioZert/. Reisch, C., Poschlod, P. (2009): Land use affects flowering time: seasonal and genetic differentiation in the grassland plant Scabiosa columbaria. Evol. Ecol. 23, 753-764.
–, Schmidkonz, S., Meier, K. et al. (2017): Genetic diversity of calcareous grassland plant species depends on historical landscape configuration. BMC Ecology 17, DOI: 10.1186/s12898-017-0129-9.
Ruprecht, E., Enyedi, M.Z., Eckstein, R.L., Donath, T.W. (2010): Restorative removal of plant litter and vegetation 40 years after abandonment enhances re-emergence of steppe grassland vegetation. Biolog. Cons. 143, 449-456.
Scheper, J., Holzschuh, A., Kuussaari, M. et al. (2013): Environmental factors driving the effectiveness of European agrienvironmental measures in mitigating pollinator loss – a metaanalysis. Ecol. Letters 16 (7), 912-920.
Schenkenberger, J. (2020): Gebietseigene Herkünfte – Ende der Übergangsfrist: Droht ein Versorgungsengpass? Naturschutz u. Landschaftspl. 52 (3), 116-121.
Schleuning, M., Fründ, J., Schweiger, O. et al. (2016): Ecological networks are more sensitive to plant than to animal extinction under climate change. Nat. Commun. 7, 13965 DOI: 10.1038/ncomms13965.
Schmid-Egger, C., Witt, R. (2014): Ackerblühstreifen für Wildbienen – Was bringen sie wirklich? Ampulex 6.; www.vademecumverlag.de/images/bilder1/Ampulex6- 2014SchmidEggerWitt.pdf.
Schmiede, R., Otte, A., Donath, T.W. (2012): Artenanreicherung durch Mahdgutübertragung in artenarmen Grünlandbeständen – welche Störungsintensität der Grasnarbe ist nötig? Naturschutz u. Biolog. Vielfalt 115, 153-171.
Schreiber, K.F., Neitzke, A. (1991): Mähen und Mulchen. Biotoppflege – Biotopentwicklung. Maßnahmen zur Stützung und Initiierung von Lebensräumen für Tiere und Pflanzen. – Teil 1, Forschungsges. Landschaftsentw. u. Landschaftsbau e.V., 78-90.
Schumacher, J., Schumacher, A. (2020): Ausbringen von Pflanzen in der freien Natur. – Was regelt § 40 Abs. 1 BNatSchG? Naturschutz u. Landschaftspl. 52 (3), 140-141.
Schwand, I., Kätzel, R., Kirchner, T. et al. (2009): Wildlebende Verwandte von Kulturpflanzen – eine Grundlage für die Sicherung der genetischen Nachhaltigkeit. Archiv f. Forstw. u. Landschaftsök. 43, 108-115.
Segerer, A. H. (2019): Rückgang der Schmetterlinge in Bayern. Jahrb. V. z. Schutz d. Bergwelt 84, 15-58.
Seibold, S., Gossner, M.M., Simons, N.K. et al. (2019): Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574, 671-674.
Seitz, B., Kowarik, I. (Hrsg.; 2003): Perspektiven für die Verwendung gebietseigener Gehölze. Neobiota 2, 3-26.
Slatkin, M. (1987): Gene flow and the geographic structure of natural populations. Science 236, 787-792.
Sorg, M., Schwan, H., Stenmans, W., Müller, A. (2013): Ermittlung der Biomassen flugaktiver Insekten im Naturschutzgebiet Orbroicher Bruch mit Malaise Fallen in den Jahren 1989 und 2013. Mitt. Entomolog. V. Krefeld 1, 1-5.
Steffan-Dewenter, I., Tscharntke, T (1999): Effects of habitat isolation on pollinator communities and seed set. Oecologia 121, 432-440.
–, Münzenberg, U., Bürger, C. et al. (2002): Scale-Dependent Effects of Landscape Context on Three Pollinator Guilds. Ecology 83 (5), 1421-1432.
Steffen, W., Richardson, K., Rockström, J. et al. (2015): Planetary boundaries: Guiding human development on a changing planet. Science 347 (6223). DOI: 10.1126/science.1259855.
Stinchcombe, J.R., Weinig, C., Ungerer, M. et al. (2004): A latitudinal cline in flowering time in Arabidopsis thaliana modulated by the flowering gene FRIGIDA. Proc. Natl. Acad. Sci. USA 101, 4712-4717.
StMUV (Bayer. Staatsmin. f. Umwelt u. Verbraucherschutz; 2020): Gemeinsam für mehr Artenvielfalt. Broschüre: 60 S.
Tscharntke, T., Greiler, H.-J., Steffan-Dewenter, I.et al. (1996). Die Flächenstilllegung in der Landwirtschaft – eine Chance für Flora und Fauna der Agrarlandschaft? NNA-Ber. 2, 59- 72.
Uyttenbroeck, R., Hatt, S., Paul, A. et al. (2016): Pros and cons of flowers strips for farmers. A review. Biotechnol. Agron. Soc. Environ. 20 (S1), 225-235.
van de Poel, D., Zehm, A. (2014): Die Wirkung des Mähens auf die Fauna der Wiesen (…). ANLiegen Natur 36, 36-51.
van der Mijnsbrugge, K., Bischoff, A., Smith, B. (2010): A question of origin: Where and how to collect seed for ecological restoration. Basic App. Ecol. 11, 300-311.
van Klink, R., Bowler, D. E., Gongalsky, K. B. et al. (2020): Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science 368, 417-420.
Volksbegehren (2020): https://volksbegehren-artenvielfalt.de/.
Völler, E., Bossdorf, O., Prati, D., Auge, H. (2017): Evolutionary responses to land use in eight common grassland plants. J. Ecol. 105, 1290-1297.
von Brackel, W. (2010): Neuanlage von Magerrasen auf Ausgleichsflächen der Stadt München – Vergleich verschiedener Techniken. ANLiegen Natur 34, 9-24. VWW (2020): www.natur-im-vww.de/.
Wagner, C., Bachl-Staudinger, M., Baumholzer, S. et al. (2014): Faunistische Evaluierung von Blühflächen. Schriftenr. Bayer. Landesanst. f. Landw. 1, 1-150.
Wenzel, M., Schmitt, T., Weitzel, M., Seitz, A. (2006): The severe decline of butterflies on western German calcaerous grasslands during the last 30 years: A conservation problem. Biolog. Cons. 128 (4), 542-552.
Westrich, P. (1990): Die Wildbienen Baden-Württembergs. Ulmer, 431 S. Stuttgart.
Zahlheimer, W. (2013): Mit Naturgemischen zu naturgemäßen Wiesenbiotopen. ANLiegen Natur 35, 25-29.
Fazit für die Praxis
Dauerhafte Flächen (Wiesen, Säume):
- Ökologischen Sachverstand hinzuziehen – um das Potenzial der Flächen einzuschätzen, die Standorte auszuwählen, geeignete Saatmischungen und Pflegekonzepte festzulegen.
- Prüfen, ob durch Extensivieren oder Optimieren von bestehendem Grünland/bestehenden Brachen mehr für einen nachhaltigen Artenschutz getan werden kann als durch eine Neuanlage.
- Vor einer Ansaat prüfen, ob eine Samenübertragung von nahegelegenen Spenderflächen möglich ist; Ansprechpartner sind Landschaftspflegeverbände und Naturschutzbehörden.
- Auf Magerstandorten und Ruderalflächen Selbstbegrünung testen – (gekaufte) Samenmischungen nur auf mittleren und produktiven Standorten einsetzen.
- Bei der Anlage Böden nicht mit Humusdecke anreichern, nicht oder nur mäßig düngen.
- Möglichst nur zertifiziertes, gebietseigenes Saatgut verwenden – auch innerörtlich.
Temporäre Flächen (Blühflächen und -streifen):
- Auf Äckern extensive Acker(randstreifen)bewirtschaftung oder Brachlegung angesäten Blühflächen vorziehen. Vor allem magere Ackerstandorte bergen oft ein großes Potenzial und auch noch die Samen seltener Ackerwildkräuter, deren Auflaufen durch Blühflächen verhindert wird. Wenn die Samenbank nicht mehr vorhanden ist, prüfen, ob gebietseigenes Ackerwildkrautsaatgut zur Verfügung steht, das zur Begründung artenreicher Äcker angesät werden kann.
- Bei Agrarumweltprogrammen muss die naturschutzfach
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen















Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.