Die Bedeutung der Habitatqualität für den Schutz der Insektendiversität
Abstracts:
Nach dem Zweiten Weltkrieg hat der Mensch seine Umwelt mit einer nie zuvor gekannten Geschwindigkeit verändert. Die Folge waren dramatische Rückgänge der Insekten. Eine hohe Habitatqualität ist von herausragender Bedeutung für das langfristige Überleben von Insekten in unseren fragmentierten Landschaften. Nachfolgend sollen vier Schlüsselfaktoren benannt werden, die die Habitatqualität entscheidend bestimmen und artenreiche Insektengemeinschaften fördern. Dies sind: 1. ein warmes Mikroklima, 2. eine große Phytodiversität, 3. eine hohe Habitatheterogenität und 4. Totholzreichtum. Mikroklimatisch begünstigte Mikrohabitate werden von vielen Insektenarten bevorzugt. Dies gilt insbesondere für seltene und gefährdete Arten. Sie sind oft auf die frühen, am stärksten wärmebegünstigten Sukzessionsstadien angewiesen. Vor allem bei Nahrungsspezialisten unter den phytophagen Insekten hängt die Diversität in einem Habitat direkt von der Phytodiversität ab. Habitatheterogenität fördert in aller Regel sowohl die Phytodiversität als auch die Zoodiversität. Viele Insektenarten sind darüber hinaus zwingend auf eine hohe Habitatheterogenität angewiesen, da ihre Entwicklungsstadien im Laufe der Individualentwicklung Mikrohabitatwechsel vollziehen. In Zeiten des Klimawandels ist Habitatheterogenität außerdem ein wirksamer Puffer gegenüber klimatischen Extremereignissen. Ein positiver Zusammenhang besteht zwischen Totholzreichtum, großem Totholzdurchmesser beziehungsweise dem Vorhandensein alter ungenutzter Wälder und der Diversität an saproxylischen (von Totholz abhängigen) Insekten.
- Veröffentlicht am
The importance of habitat quality for the conservation of insect diversity – Microclimate, phytodiversity, habitat heterogeneity and deadwood are key factors for species-rich insect assemblages
Since World War II, humans have altered environmental conditions at an unparalleled rate. This has resulted in dramatic insect declines. High habitat quality is of prime importance for the long-term survival of insects in fragmented landscapes. Here we explain four key factors that determine habitat quality and foster species-rich insect assemblages. These are: (i) a warm microclimate, (ii) high phytodiversity, (iii) high habitat heterogeneity, and (iv) richness of deadwood. Microclimatically favoured microhabitats are preferred by many insect species. Rare and threatened species are often especially dependent on the earliest and warmest successional stages. In particular, in food specialists among phytophagous insects, species richness is directly related to the phytodiversity of a habitat. Habitat heterogeneity usually fosters plant and animal diversity. Moreover, for many insect species, habitat heterogeneity is even mandatory since their different life-cycle stages fulfil microhabitat shifts during their development. In times of climate change, heterogeneity is an important additional buffer against extreme climatic events. There is a positive relationship between the amount of deadwood, large deadwood diameter, or the occurrence of ancient, unused woodlands, and the diversity of saproxylic insects.
1 Einleitung
Insekten sind die artenreichste Organismengruppe auf der Erde (Stork 2018). Sie übernehmen eine Vielzahl an Ökosystemleistungen (Powney et al. 2019, Samways et al. 2020) und sind folglich gleichermaßen bedeutsam für den Fortbestand von Ökosystemen und das menschliche Wohlergehen. In den zurückliegenden 200 Jahren und insbesondere nach dem Zweiten Weltkrieg hat der Mensch seine Umwelt mit einer nie zuvor gekannten Geschwindigkeit verändert (Fartmann et al. 2021, Rockström et al. 2009). Die Folge waren unter anderem dramatische Rückgänge der Insekten (Cardoso et al. 2020, Fartmann et al. 2021, Sánchez-Bayo & Wyckhuys 2019).
Der Landnutzungswandel hatte eine starke Nivellierung der Standorteigenschaften und eine Homogenisierung auf der Habitat- und Landschaftsebene zur Folge (Fartmann et al. 2021). Nährstoffarme und artenreiche Lebensräume, wie zum Beispiel nährstoffarme Äcker, Grünlandflächen, Magerrasen, Heiden oder Moore sowie traditionell genutzte oder altholzreiche Wälder, mit reicher Insektenfauna sind heutzutage meist nur noch kleinflächig und fragmentiert in unserer Landschaft vorhanden (Fartmann 2017, Fartmann et al. 2019, 2021). Die wenigen verbliebenen Habitatfragmente sind zudem von einer zunehmend lebensfeindlichen Landschaftsmatrix umgeben.
Die Schlüsselfaktoren für den Fortbestand der Insektengemeinschaften in diesen Lebensrauminseln sind die Qualität, Größe und Konnektivität der Habitate (Fahrig 2003, Fartmann 2017, Fartmann et al. 2021, Fischer & Lindenmayer 2007). Die relative Bedeutung der drei Umweltfaktoren hängt einerseits von der Mobilität und der Populationsstruktur der Taxa und andererseits von der Landschaftsstruktur ab (Fartmann 2017, Fartmann et al. 2021). Eine hohe Habitatqualität ist gleichermaßen bedeutsam für Arten mit geringer Mobilität, die oft geschlossene Populationen ausbilden, und Metapopulationsarten, bei denen die lokalen (Sub-)Populationen durch Individuenaustausch miteinander verbunden sind. In schwach fragmentierten Landschaften, die noch eine große Zahl an Habitatinseln und somit eine gute Vernetzung aufweisen, ist meist die Habitatqualität der wichtigste Umweltfaktor für den Fortbestand lebensraumtypischer Insektengemeinschaften (Krämer et al. 2012, Löffler & Fartmann 2017, Münsch et al. 2019, Poniatowski et al. 2018). Mit zunehmender Fragmentierung gewinnt zusätzlich die Habitatkonnektivität an Bedeutung.
Eine hohe Habitatqualität ist somit von herausragender Bedeutung für das langfristige Überleben von Insekten in unseren fragmentierten Landschaften. Nachfolgend sollen vier Schlüsselfaktoren benannt werden, die die Habitatqualität entscheidend bestimmen und artenreiche Insektengemeinschaften im Offenland und Wald fördern. Dies sind: 1. ein warmes Mikroklima, 2. eine große Phytodiversität, 3. eine hohe Habitatheterogenität und 4. Totholzreichtum.
2 Mikroklima: Viele mögen’s heiß
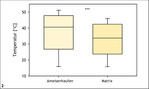
Bei ektothermen Organismen – zu denen Insekten zählen – sind Aktivität, Verhalten und Fortpflanzungserfolg von den Umgebungstemperaturen abhängig (Speight et al. 2008). Mikroklimatisch begünstigte Mikrohabitate, wie sie für frühe bis mittlere Sukzessionsstadien typisch sind (Stoutjesdijk & Barkman 1992, Streitberger & Fartmann 2015), werden daher von vielen Arten bevorzugt (Abb. 1) (Fartmann 2004, 2006 a, Fartmann et al. 2012, 2013, García-Barros & Fartmann 2009, Helbing et al. 2014). Die Gelbe Wiesenameise (Lasius flavus ) legt beispielsweise in Trockenrasen oberirdische Erdnester an, um eine erfolgreiche Entwicklung der Brut sicherzustellen (Streitberger & Fartmann 2015, 2017). Diese Nester erwärmen sich stärker als die umgebende Matrixvegetation (Abb. 2). Derart wärmebegünstige Nesthügel mit niedrigwüchsiger Vegetation und hohem Offenbodenanteil werden von Arten wie dem Komma-Dickkopffalter (Hesperia comma ) und dem Thymian-Widderchen (Zygaena purpuralis ) ebenfalls als Reproduktionshabitat präferiert (Streitberger & Fartmann 2015, 2016). Hinweise auf eine bevorzugte Nutzung von Ameisenhaufen als Eiablagehabitat gibt es beispielsweise auch bei verschiedenen Feldheuschrecken (Fartmann & Mattes 1997, Reck 1993, Schulz 2003, Waloff 1950).
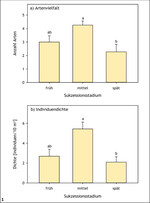
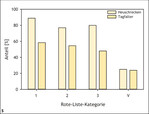
Für viele seltene und gefährdete Insektenarten sind in unserer Landschaft insbesondere die frühen, am stärksten wärmebegünstigten Sukzessionsstadien von großer Bedeutung (Abb. 3 und 4) (Fartmann 2006 a, 2017). Dies gilt sowohl für Lebensraumtypen des Offenlandes (submediterrane Kalkmagerrasen: Poniatowski & Fartmann 2008; Steppenrasen: Fartmann et al. 2012; Heiden: Schirmel et al. 2011, Schirmel & Fartmann 2014) als auch der Wälder (Fartmann et al. 2013, Helbing et al. 2014). Auch die aktuellen Roten Listen der Heuschrecken und Tagfalter Deutschlands belegen diesen Zusammenhang zwischen starker Gefährdung (Rote-Liste-Kategorie 1 bis 3) und Bindung an frühe Sukzessionsstadien (Abb. 5) (Fartmann 2017). Insbesondere bei den Heuschrecken, aber auch bei den Tagfaltern dominieren in den Gefährdungskategorien 1 bis 3 (vom Aussterben bedroht, stark gefährdet und gefährdet) Arten der frühen Sukzessionsstadien mit Anteilen von 75–90 % beziehungsweise 50–60 %. Innerhalb der Vorwarnliste machen Arten stark störungsabhängiger, wärmebegünstigter Habitate dagegen nur noch ein Viertel aus.
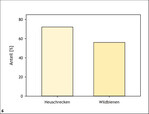
Besonnte, offene Bodenstellen sind generell bedeutende Eiablage- und Nisthabitate für zahlreiche Insekten, wie etwa viele Heuschrecken- und Hautflüglerarten (Fartmann & Mattes 1997, Schuhmacher & Fartmann 2003, Westrich 2018, Wünsch et al. 2012). Unter den in Deutschland vorkommenden Heuschrecken- und Wildbienenarten nutzen 72 % beziehungsweise 56 % der Arten überwiegend den Boden oder bodennahe Bereiche zur Fortpflanzung (Abb. 6 und 7). Besonnte offene Bodenstellen, Steine und Totholz spielen auch für die Thermoregulation vieler adulter Insekten eine elementare Rolle (siehe zum Beispiel Dennis 2010).
Auch in Wäldern fördern lichte Waldstrukturen die Insektendiversität, da hier günstige mikroklimatische Verhältnisse für wärmeliebende Insekten vorherrschen und die Krautschicht wesentlich üppiger und artenreicher ausgeprägt ist, als dies in dunklen Hochwäldern der Fall ist (Fartmann et al. 2013). Besonnten frei stehenden Bäumen sowie Waldrändern kommt beispielsweise eine hohe Bedeutung als Lebensraum für Käfer und andere Arthropoden zu. Für die in Sebek et al. (2016) untersuchten Artengruppen (Ameisen, Bienen, Käfer, Spinnen und Wespen) war die Artenvielfalt an besonnten Solitärbäumen im Vergleich zu geschlossenen Waldbereichen deutlich höher, während sie am Waldrand in den meisten Fällen intermediär war. In zwei anderen Studien war die Vielfalt diverser Käferfamilien (Bockkäfer [Cerambycidae], Prachtkäfer [Buprestidae] und Schnellkäfer [Elateridae]) innerhalb besonnter Waldbereiche und an offenstehenden, besonnten Bäumen deutlich höher als in beschatteten Bereichen (Horák & Rébl 2013, Vodka et al. 2009).
3 Phytodiversität: Viele Pflanzenarten bedeuten viele Insektenarten
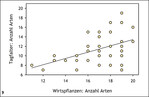
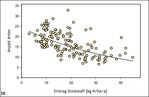
Viele Insektenarten sind auf ein ausreichendes Pollen-, Nektar- oder Wirtspflanzenangebot angewiesen. Insbesondere bei Nahrungsspezialisten (stenophage und oligolektische Arten) unter den phytophagen Insekten – wie beispielsweise viele Tagfalter-, Wildbienen- oder Zikadenarten – hängt die Diversität in einem Habitat daher direkt von der Phytodiversität ab (Abb. 8) (Helbing et al. 2017, Krämer et al. 2012, Westrich 2018). Exemplarisch wird dies für präalpine Kalkmagerrasen (Buckelwiesen) des Werdenfelser Landes (Bayern) vorgestellt: Die Artenzahl der Habitatspezialisten unter den Tagfalterarten nahm mit der Anzahl der Wirtspflanzenarten im Habitat zu (Abb. 9) (Krämer et al. 2012). Eine große Pflanzenartenvielfalt ist in aller Regel auf Nährstoffarmut und extensive Nutzung zurückzuführen (Abb. 10) (Ellenberg & Leuschner 2010, Stevens et al. 2010). Konkurrenzkräftige Pflanzenarten werden dadurch geschwächt, es gelangt ausreichend Licht in Bodennähe, und Regenerationsnischen für konkurrenzschwache Pflanzenarten entstehen (Fleischer et al. 2013, Streitberger et al. 2017).
In gehölzdominierten Lebensraumtypen hat neben der Phytodiversität der Krautschicht auch die Artenzusammensetzung der Strauch- und Baumschicht einen entscheidenden Einfluss auf die Artenvielfalt der Insektengemeinschaften. In Deutschland weisen Weiden (Salix spec.) mit 718 Arten, gefolgt von Eichen (Quercus spec.) mit 695 Arten die mit Abstand größte Zahl an ihnen lebender phytophager Insektenarten auf (Brändle & Brandl 2001). Dies gilt auch für auf eine Gattung spezialisierte Insektenarten (monophage Arten). Die Artenzusammensetzung der an einem Baum lebenden Holzkäfer-Zönose wird ebenfalls von der Baumart mitbestimmt. Unter den einheimischen Baum- arten weisen vor allem Eichen, aber auch Buchen eine etwas höhere Bedeutung für xylobionte (holzbewohnende) Käfer auf als andere Baumarten (Lorenz 2005, Milberg et al. 2014, Vogel et al. 2021, Walentowski et al. 2014).
4 Habitatheterogenität: Vielfalt ist der Schlüssel
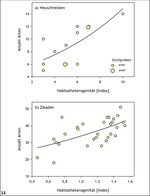
Habitatheterogenität bedeutet eine größere Vielfalt an Mikrohabitaten in einem Lebensraum (Abb. 11 und 12), wodurch in aller Regel sowohl die Phytodiversität (Brose 2001, Ellenberg & Leuschner 2010, Grime 2001, Holtmann et al. 2019) als auch die Zoodiversität (Fartmann et al. 2012, 2013, Helbing et al. 2017, Krämer et al. 2012, Löffler & Fartmann 2017, Schirmel et al. 2010) gefördert werden. Dieser Zusammenhang wurde beispielsweise für Heuschrecken in präalpinen Kalkmagerasen (Buckelwiesen) des Werdenfelser Landes (Oberbayern) und Zikaden in Silikatmagerrasen der Medebacher Bucht (Südwestfalen) nachgewiesen (Abb. 13).
Viele Insektenarten sind darüber hinaus zwingend auf eine hohe Habitatheterogenität angewiesen, da ihre Entwicklungsstadien im Laufe ihrer Individualentwicklung Mikrohabitatwechsel vollziehen müssen (Fartmann 2017, Speight et al. 2008). Bei Insekten besonders gut belegt ist dies beispielsweise für große Langfühlerschrecken wie den Warzenbeißer (Decticus verrucivorus ) (Schirmel et al. 2010, Schuhmacher & Fartmann 2003, Wünsch et al. 2012). Aber auch bei kleineren Arten wie der Gefleckten Keulenschrecke (Myrmeleotettix maculatus ) und der Westlichen Beißschrecke (Platycleis albopunctata ) unterscheiden sich die Mikrohabitate der verschiedenen Entwicklungsstadien (Eier, junge Larven, alte Larven, Imagines) deutlich voneinander (Wünsch et al. 2012). Mit zunehmender Größe und voranschreitender Vegetationsperiode – verbunden mit höheren Temperaturen – suchen die Tiere verstärkt höhere Vegetation auf, die genügend Schutz vor Feinden und zu hohen Temperaturen sowie ausreichend Nahrung bietet.
In Zeiten des Klimawandels ist Habitat-heterogenität zudem ein wirksamer Puffer gegenüber klimatischen Extremereignissen (Fartmann 2006 b, Streitberger et al. 2016 a, b, Stuhldreher & Fartmann 2018). Heterogene Habitate sind resilienter gegenüber solchen Ereignissen und die Wahrscheinlichkeit für ein langfristiges Überleben der Arten in derartigen Lebensräumen ist größer. Die Arten haben hier mehr Möglichkeiten, durch Mikrohabitatwechsel auf extreme Wetter- oder Witterungsbedingungen zu reagieren.
5 Totholz: ein Garant für Insektenvielfalt
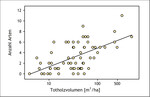
Insekten, die auf Totholz angewiesen sind (saproxylische Arten), sind eine besonders artenreiche Gilde. Beispielsweise sind aus Nordeuropa fast 4.000 saproxylische Insektenarten bekannt, wobei die tatsächliche Zahl noch höher sein dürfte (Stokland et al. 2012). In Deutschland gibt es allein unter den Käfern mehr als 600 Totholzbewohner (Schmidl & Bußler 2004). Zugleich zählen die saproxylischen Insekten zu den besonders gefährdeten Taxa in mitteleuropäischen Wäldern (Abb. 14 und 15) (Grove 2002, Seibold et al. 2015). Zum Beispiel steht mehr als die Hälfte der totholzbewohnenden Käfer in Deutschland auf der Roten Liste (Schmidl & Bußler 2004). Zahlreiche Studien belegen den positiven Zusammenhang zwischen Totholzreichtum, großem Totholzdurchmesser beziehungsweise dem Vorhandensein alter ungenutzter Wälder und einer hohen Diversität an saproxylischen Insekten (Abb. 16) (Grove 2002, Müller & Bütler 2010).
Zwar ist der Totholzanteil in Wäldern im Laufe der letzten Jahrzehnte aufgrund diverser sozioökonomischer Entwicklungen angestiegen (Fartmann et al. 2021, Gatter 2000), dennoch sind die heutigen Mengen noch nicht ausreichend, um die Bestände saproxylischer Insekten ausreichend zu fördern (Fartmann et al. 2021, Müller & Bütler 2010). Dies trifft insbesondere auf das für saproxylische Insekten besonders wichtige Totholz mit einem großen Durchmesser (Seibold et al. 2015) und besonntes Totholz (Vodka et al. 2009, Whitehouse 2006) zu.
Literatur
Brändle, M., Brandl, R. (2001): Species richness of insects and mites on trees: expanding Southwood. Journal of Animal Ecology 70, 491-504. Brose, U. (2001): Relative importance of isolation, area and habitat heterogeneity for vascular plant species richness of temporary wetlands in east-German farmland. Ecography 24, 722-730.
Cardoso, P., Barton, P. S., Birkhofer, K., Chichorro, F., Deacon, C., Fartmann, T., Fukushima, C. S., Gaigher, R., Habel, J., Hallmann, C. A., Hill, M., Hochkirch, A., Kwak, M. L., Mammola, S., Noriega, J. A., Orfinger, A. B., Pedraza, F., Pryke, J. S., Roque, F. O., Settele, J., Simaika, J. P., Stork, N. E., Suhling, F., Vorster, C., Samways, M. J. (2020): Scientists’ warning to humanity on insect extinctions. Biological Conservation 242, 108426.
Dennis, R. L. H. (2010): A Resource-based Habitat View for Conservation: Butterflies in the British Landscape. Verlag Wiley-Blackwell, Oxford (UK).
Ellenberg, H., Leuschner, C. (2010): Vegetation Mitteleuropas mit den Alpen, 6. Aufl. Verlag Eugen Ulmer, Stuttgart 1333 S.
Fahrig, L. (2003): Effects of habitat fragmentation on biodiversity. Annual Review of Ecology, Evolution, and Systematics 34, 487-515.
Fartmann, T. (2004): Die Schmetterlingsgemeinschaften der Halbtrockenrasen-Komplexe des Diemeltales. Biozönologie von Tagfaltern und Widderchen in einer alten Hudelandschaft. Abhandlungen aus dem Westfälischen Museum für Naturkunde 66, 1-256.
– (2006a): Welche Rolle spielen Störungen für Tagfalter und Widderchen? In: Fartmann, T., Hermann, G. (Hrsg.): Larvalökologie von Tagfaltern und Widderchen in Mitteleuropa. Abhandlungen aus dem Westfälischen Museum für Naturkunde 68 (3/4), 259-270.
– (2006b): Oviposition preferences, adjacency of old woodland and isolation explain the distribution of the Duke of Burgundy butterfly (Hamearis lucina) in calcareous grasslands in central Germany. Annales Zoologici Fennici 43 (4), 335-347.
– (2017): Überleben in fragmentierten Landschaften. Grundlagen für den Schutz der Biodiversität Mitteleuropas in Zeiten des globalen Wandels. Naturschutz und Landschaftsplanung 49 (9), 277- 282.
–, Jedicke, E., Stuhldreher, G., Streitberger, M. (2021): Insektensterben in Mitteleuropa – Ursachen und Gegenmaßnahmen. Verlag Eugen Ulmer, Stuttgart-Hohenheim (im Druck).
–, Krämer, B., Stelzner, F., Poniatowski, D. (2012): Orthoptera as ecological indicators for succession in steppe grassland. Ecological Indicators 20, 337-344.
–, Mattes H. (1997): Heuschreckenfauna und Grünland – Bewirtschaftungsmaßnahmen und Biotopmanagement. Arbeiten aus dem Institut für Landschaftsökologie 3, 179-188.
–, Müller, C., Poniatowski, D. (2013): Effects of coppicing on butterfly communities of woodlands. Biological Conservation 159, 396-404.
–, Poniatowski, D., Stuhldreher, G., Streitberger, M. (2019): Insektenrückgang und -schutz in den fragmentierten Landschaften Mitteleuropas. Natur und Landschaft 94 (6/7), 261-270.
Fischer, J., Lindenmayer, D. B. (2007): Landscape modification and habitat fragmentation: a synthesis. Global Ecology and Biogeography 16, 265-280.
Fleischer K., Streitberger M., Fartmann T. (2013): The importance of disturbance for the conservation of a low-competitive herb in mesotrophic grasslands. Biologia 68, 398-403.
García-Barros, E., Fartmann, T. (2009): Butterfly Oviposition: Sites, Behaviour and Modes. In: Settele, J., Shreeve, T., Konvicka, M., Van Dyck, H. (Hrsg.): Ecology of Butterflies in Europe. Cambridge University Press, Cambridge, 29-42.
Gatter, W. (2000): Vogelzug und Vogelbestände in Mitteleuropa. 30 Jahre Beobachtung des Tagzugs am Randecker Maar. AULA-Verlag, Wiebelsheim. Grime, J. P. (2001): Plant strategies, vegetation processes, and ecosystem properties. 2. Aufl. John Wiley and Sons, Chicester (UK).
Grove, S. J. (2002): Saproxylic insect ecology and the sustainable management of forests. Annual Review of Ecology and Systematics 33, 1-23.
Helbing, F., Blaeser, T. P., Löffler, F., Fartmann, T. (2014): Response of Orthoptera communities to succession in alluvial pine woodlands. Journal of Insect Conservation 18, 215-224.
–, Fartmann, T., Löffler, F., Poniatowski, D. (2017): Effects of local climate, landscape structure and habitat quality on leafhopper assemblages of acidic grasslands. Agriculture, Ecosystems & Environment 246, 94-101.
Holtmann, L., Kerler, K., Wolfgart, L., Schmidt, C., Fartmann, T. (2019): Habitat heterogeneity determines plant species richness in urban stormwater ponds. Ecological Engineering 138, 434- 443.
Horák, J., Rébl, K. (2013): The species richness of click beetles in ancient pasture woodland benefits from a high level of sun exposure. Journal of Insect Conservation 17 (2), 307-318.
Krämer, B., Poniatowski, D., Fartmann, T. (2012): Effects of landscape and habitat quality on butterfly communities in pre-alpine calcareous grasslands. Biological Conservation 152, 253-261.
Lorenz, J. (2005): Schnellmethode der Totholz-Strukturkartierung. Naturschutz und Landschaftsplanung 37, 342-349.
Löffler, F., Fartmann, T. (2017): Effects of landscape and habitat quality on Orthoptera assemblages of pre-alpine calcareous grasslands. Agriculture, Ecosystems & Environment 248, 71-81.
Milberg, P., Bergman, K. O., Johansson, H., Jansson, N. (2014): Low host-tree preferences among saproxylic beetles: a comparison of four deciduous species. Insect Conservation and Diversity 7 (6), 508-522.
Müller, J., Bütler, R. (2010): A review of habitat thresholds for dead wood: a baseline for management recommendations in European forests. European Journal of Forest Research 129 (6), 981-992.
Münsch, T., Helbing, F., Fartmann, T. (2019): Habitat quality determines patch occupancy of two specialist Lepidoptera species in well-connected grasslands. Journal of Insect Conservation 23, 247-258.
Poniatowski, D., Fartmann T. (2008): The classification of insect communities: Lessons from Orthoptera assemblages of semi-dry calcareous grasslands in central Germany. European Journal of Entomology 105, 659-671.
–, Stuhldreher, G., Löffler, F., Fartmann, T. (2018): Patch occupancy of grassland specialists: Habitat quality matters more than habitat connectivity. Biological Conservation 225, 237-244.
Powney, G. D., Carvell, C., Edwards, M., Morris, R. K. A., Roy, H. E., Woodcock, B. A., Isaac, N. J. B. (2019): Widespread losses of pollinating insects in Britain. Nature Communications 10, 1018.
Reck, H. (1993): Haben Tierbauten eine Bedeutung als Habitatbaustein für den Feldgrashüpfer (Chorthippus apricarius L. 1758)? Articulata 8, 45-51.
Rockström, J., Steffen, W., Noone, K., Persson, A., Chapin, F. S., Lambin, E. F., Lenton, T. M., Scheffer, M., Folke, C., Schellnhuber, H. J., Nykvist, B., Wit, C. A. de, Hughes, T., van der Leeuw, S., Rodhe, H., Sörlin, S., Snyder, P. K., Costanza, R., Svedin, U., Falkenmark, M., Karlberg, L., Corell, R. W., Fabry, V. J., Hansen, J., Walker, B., Liverman, D., Richardson, K., Crutzen, P., Foley, J. A. (2009): A safe operating space for humanity. Nature 461, 472-475.
Samways, M. J., Barton, P. S., Birkhofer, K., Chichorro, F., Deacon, C., Fartmann, T., Fukushima, C. S., Gaigher, R., Habel, J., Hallmann, C. A., Hill, M., Hochkirch, A., Kwak, M. L., Kaila, L., Maes, D., Mammola, S., Noriega, J. A., Orfinger, A. B., Pedraza, F., Pryke, J. S., Roque, F. O., Settele, J., Simaika, J. P., Stork, N. E., Suhling, F., Vorster, C., Cardoso, P. (2020): Solutions for humanity on how to conserve insects. Biological Conservation 242, 108427. Sánchez-Bayo, F., Wyckhuys, K. A. (2019): Worldwide decline of the entomofauna: A review of its drivers. Biological Conservation 232, 8-27.
Schirmel, J., Blindow, I., Fartmann, T. (2010): The importance of habitat mosaics for Orthoptera (Caelifera and Ensifera) in dry heathlands. European Journal of Entomology 107, 129-132.
–, Fartmann, T. (2014): Coastal heathland succession influences butterfly community composition and threatens endangered butterfly species. Journal of Insect Conservation 18, 111-120.
–, Mantilla-Contreras, J., Blindow, I., Fartmann, T. (2011): Impacts of succession and grass encroachment on Orthoptera in heathlands. Journal of Insect Conservation 15, 633-642.
Schmidl, J., Bußler, H. (2004): Ökologische Gilden xylobionter Käfer Deutschlands. Naturschutz und Landschaftsplanung 36, 202-217.
Schuhmacher, O., Fartmann, T. (2003): Offene Bodenstellen und eine heterogene Raumstruktur – Schlüsselrequisiten im Lebensraum des Warzenbeißers (Decticus verrucivorus). Articulata 18 (1), 71-93.
Schulz, B. (2003): Zur Bedeutung von Beweidung und Störstellen für Tierarten am Beispiel der Verteilung von Feldheuschreckengelegen im Grünland. Articulata 18, 151-178.
Sebek, P., Vodka, S., Bogusch, P., Pech, P., Tropek, R., Weiss, M., Zimova, K., Cizek, L. (2016): Opengrown trees as key habitats for arthropods in temperate woodlands: the diversity, composition, and conservation value of associated communities. Forest Ecology and Management 380, 172- 181.
Seibold, S., Brandl, R., Buse, J., Hothorn, T., Schmidl, J., Thorn, S., Müller, J. (2015): Association of extinction risk of saproxylic beetles with ecological degradation of forests in Europe. Conservation Biology 29 (2), 382-390.
Speight, M. R., Hunter, M. D., Watt, A. D. (2008): Ecology of Insects. Concepts and Applications. Wiley-Blackwell, Chichester.
Stevens, C. J., Duprè, C., Dorland, E., Gaudnik, C., Gowing, D. J. G., Bleeker, A., Diekmann, M., Alard, D., Bobbink, R., Fowler, D., Corcket, E., Mountford, J. O., Vandvik, V., Aarrestad, P. A., Muller, S., Dise, N. B. (2010): Nitrogen deposition threatens species richness of grasslands across Europe. Environmental Pollution 158, 2940e2945. www.nul-online.de 4 Stokland, J. N., Siitonen, J., Jonsson, B. G. (2012): Biodiversity in Dead Wood. Cambridge University Press, Cambridge.
Stork, N. E. (2018): How many species of insects and other terrestrial arthropods are there on Earth? Annual Review of Entomology, 63, 31-45.
Stoutjesdijk, P., Barkman, J. J. (1992): Microclimate, Vegetation and Fauna. Opulus Press, Knivsta. Streitberger, M., Fartmann, T. (2015): Vegetation and climate determine ant-mound occupancy by a declining herbivorous insect in grasslands. Acta Oecologica 68, 43-49.
–, Fartmann, T. (2016): Vegetation heterogeneity caused by an ecosystem engineer drives oviposition-site selection of a threatened grassland insect. Arthropod-Plant Interactions 10, 545- 555.
–, Fartmann, T. (2017): Bodenstörende Ökosystem-Ingenieure im mitteleuropäischen Grasland und ihre Bedeutung für die Biodiversität. Eine Analyse am Beispiel der Gelben Wiesenameise und des Europäischen Maulwurfs. Naturschutz und Landschaftsplanung 49 (8), 252-259.
–, Ackermann, W., Fartmann, T., Kriegel, G., Ruff, A., Balzer, S., Nehring, S. (2016a): Artenschutz unter Klimawandel: Perspektiven für ein zukunftsfähiges Handlungskonzept. Naturschutz und Biologische Vielfalt 147, 1-367.
–, Jedicke, E., Fartmann, T. (2016b): Auswirkungen des rezenten Klimawandels auf die Biodiversität in Mittelgebirgen – eine Literaturstudie zu Arten und Lebensräumen. Naturschutz und Landschaftsplanung 48 (2), 37-45.
–, Schmidt, C., Fartmann, T. (2017): Contrasting response of vascular plant and bryophyte species assemblages to a soil-disturbing ecosystem engineer in calcareous grasslands. Ecological Engineering 99, 391-399.
Stuhldreher, G., Fartmann, T. (2018): Threatened grassland butterflies as indicators of microclimatic niches along an elevational gradient – Implications for conservation in times of climate change. Ecological Indicators 94, 83-98.
Vodka, S., Konvicka, M., Cizek, L. (2009): Habitat preferences of oak-feeding xylophagous beetles in a temperate woodland: implications for forest history and management. Journal of Insect Conservation 13 (5), 553-562.
Vogel, S., Bußler, H., Finnberg, S., Müller, J., Stengel, E., Thorn, S. (2021): Diversity and conservation of saproxylic beetles in 42 European tree species: an experimental approach using early successional stages of branches. Insect Conservation and Diversity 14 (1), 132-143.
Walentowski, H., Müller-Kroehling, S., Bergmeier, E., Bernhardt-Römermann, M., Gossner M. M., Reif, A., Schulze E.-D., Bußler H., Strätz C., Adelmann, W (2014): Faunal diversity of Fagus sylvatica forests: A regional and European perspective based on three indicator groups. Annals of Forest Research 57 (2), 215-231.
Waloff, N. (1950): The egg pods of British short-horned grasshoppers (Acrididae). Proceedings of the Royal Entomological Society of London, Series A, General Entomology 25, 115-126. Westrich, P. (2018): Die Wildbienen Deutschlands. Verlag Eugen Ulmer, Stuttgart, 821 S.
Whitehouse, N. J. (2006): Holocene British and Irish ancient forest fossil beetle fauna: implications for forest history, biodiversity and faunal colonisation. Quaternary Science Reviews 25 (15/16), 1755- 1789.
Wünsch, Y., Schirmel, J., Fartmann, T. (2012): Conservation management of coastal dunes for Orthoptera has to consider oviposition and nymphal preferences. Journal of Insect Conservation 16, 501-510.
Fazit für die Praxis
- Schlüsselfaktoren, die artenreiche Insektengemeinschaften fördern sind: 1. ein warmes Mikroklima, 2. eine große Phytodiversität, 3. eine hohe Habitatheterogenität und 4. Totholzreichtum.
- Mikroklimatisch begünstigte Mikrohabitate werden von vielen Insektenarten bevorzugt. Dies gilt insbesondere für seltene und gefährdete Arten. Sie sind oft auf die frühen, am stärksten wärmebegünstigten Sukzessionsstadien angewiesen.
- Vor allem bei Nahrungsspezialisten unter den phytophagen Insekten hängt die Diversität in einem Habitat direkt von der Phytodiversität ab.
- Habitatheterogenität fördert in aller Regel sowohl die Phytodiversität als auch die Zoodiversität. Viele Insektenarten sind darüber hinaus zwingend auf eine hohe Habitatheterogenität angewiesen, da ihre Entwicklungsstadien im Laufe der Individualentwicklung Mikrohabitatwechsel vollziehen. In Zeiten des Klimawandels ist Habitatheterogenität außerdem ein wirksamer Puffer gegenüber klimatischen Extremereignissen.
- Es besteht ein positiver Zusammenhang zwischen Totholzreichtum, großem Baum- und Totholzdurchmesser beziehungsweise dem Vorhandensein alter ungenutzter Waldbestände und einer hohen Diversität an saproxylischen Insekten.
Kontakt

Prof. Dr. Thomas Fartmann ist Ökologe und Biogeograph. Er leitet die Abteilung Biodiversität und Landschaftsökologie an der Universität Osnabrück. Forschungsschwerpunkte sind unter anderem Auswirkungen des rezenten Landnutzungs- und Klimawandels auf die Biodiversität, Störungsökologie und Renaturierungsökologie. Veröffentlichung von bislang mehr als 200 wissenschaftlichen Publikationen.


> merle.streitberger@uni-osnabrueck.de
Felix Helbing, Landschaftsökologe, Abteilung Biodiversität und Landschaftsökologie der Universität Osnabrück.
Von Thomas Fartmann, Gregor Stuhldreher, Merle Streitberger und Felix Helbing.
Eingereicht am 10. 03. 2021, angenommen am 24. 04. 2021
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen


















Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.