Aussterbeschuld: zeitverzögertes Aussterben von Arten
Abstracts
Seit dem Beginn des Industriezeitalters hat der Mensch seine Umwelt in beispielloser Geschwindigkeit verändert, mit dramatischen Auswirkungen auf die Biodiversität. Neuere Studien zeigen, dass Aussterbeereignisse oft zeitverzögert auf Umweltveränderungen erfolgen. Dieses Phänomen wird in der Ökologie, abgeleitet vom englischen Ausdruckextinction debt , als Aussterbeschuld bezeichnet. Nachfolgend werden das Konzept der Aussterbeschuld und dessen Bedeutung für den Naturschutz ausführlich vorgestellt.
Aussterbeschuld beschreibt das Phänomen, dass Populationen bzw. Arten nicht sofort nach Verschlechterung ihrer Lebensbedingungen verschwinden, sondern oft erst mit deutlicher Zeitverzögerung. „Schuld“ ist hier also nicht im Sinne einer Verantwortlichkeit zu verstehen, sondern als „Rückstand“ bzw. „Verzug“. Die Gründe für das Auftreten einer Aussterbeschuld können sehr unterschiedlich sein. Im einfachsten Fall pflanzt sich eine langlebige Art nicht mehr erfolgreich fort oder zumindest nicht in dem Umfang, wie es für den dauerhaften Fortbestand der Population erforderlich wäre.
Ein Zeitversatz zwischen dem Auftreten einer Umweltveränderung und dem Aussterben von Arten kann dazu führen, dass die Ursachen von Bestandsrückgängen nicht erkannt werden oder gar falsche Schlüsse für den Naturschutz gezogen werden. Dies ist oft bei schleichenden Veränderungen der Fall, beispielsweise der langsamen Abnahme der Habitatqualität. Im ungünstigsten Fall wird die eigentliche Ursache nicht als solche in Betracht gezogen, weil sie schon mehrere Jahre oder auch Jahrzehnte zuvor gewirkt hat. Extinction debt – time-delayed extinction of species
A phenomenon that has hardly been considered in nature conservation practice
Since the beginning of the industrial era, humankind has altered the environment at an unprecedented rate, causing a dramatic loss of biodiversity. Recent studies have revealed that extinction events often occur with a time delay. In ecology, this phenomenon is termed extinction debt. Here we give an overview of the concept of extinction debt and its implications for biodiversity conservation.
Extinction debt refers to the phenomenon that populations or species become extinct with a time lag and not immediately after habitat conditions have deteriorated. The causes for the occurrence of extinction debt can vary widely. In the simplest case, a long-lived species is no longer able to reproduce as much as would be necessary for the long-term survival of its population.
The time delay between the occurrence of the environmental change and the extinction event may result in a lack of identification or a misidentification of the relevant causes. This is especially true for gradual environmental changes, for example in habitat quality. At worst, the real cause will not be detected as it occurred several years or even decades earlier.
- Veröffentlicht am

1 Einleitung
Die aktuelle Biodiversitätskrise stellt eine der größten gesellschaftlichen Herausforderungen dar. Seit dem Beginn des Industriezeitalters hat der Mensch seine Umwelt mit beispielloser Geschwindigkeit verändert (Rockström et al. 2009). Die Folge waren dramatische Rückgänge der Häufigkeit und Vielfalt von Arten (Cardoso et al. 2020, Dirzo et al. 2014, Eichenberg et al. 2021, Fartmann et al. 2021, IPBES 2019).
Für Landökosysteme gilt insbesondere der Landnutzungswandel als die treibende Kraft hinter diesen Abnahmen (Cardoso et al. 2020, Fartmann et al. 2021, IPBES 2019, Wagner 2020). Bis Mitte des 20. Jahrhunderts dominierten großflächig nährstoffarme Lebensräume die Landschaften Mitteleuropas (Poschlod 2017). Aufgrund der extensiven Landnutzung herrschte kleinräumig eine hohe strukturelle Vielfalt vor (Ellenberg & Leuschner 2010, Gatter 2000, Poschlod 2017), die wiederum arten- und individuenreiche Lebensgemeinschaften begünstigte (Fartmann et al. 2021).
Mit fortschreitender Industrialisierung der Landwirtschaft – insbesondere nach dem Zweiten Weltkrieg – kam es zu gravierenden Veränderungen der mitteleuropäischen Landschaften (Ellenberg & Leuschner 2010, Fartmann 2017, Fartmann et al. 2019, 2021, Gatter 2000, Poschlod 2017). Insgesamt hatte der Landnutzungswandel eine starke Nivellierung der Standorteigenschaften und eine Homogenisierung auf der Habitat- und Landschaftsebene zur Folge. Nährstoffarme und artenreiche Lebensräume, wie zum Beispiel nährstoffarme Äcker, Grünlandflächen, Magerrasen, Heiden, Moore oder traditionell genutzte Wälder, kommen in Mitteleuropa heutzutage meist nur noch kleinflächig und fragmentiert vor und sind von einer zunehmend lebensfeindlicheren Matrix (zum Beispiel intensiv genutzte Äcker) umgeben (Fartmann 2017, Fartmann et al. 2019, 2021). Der Fortbestand der Lebensgemeinschaften in diesen Habitatfragmenten ist häufig durch eine verringerte Habitatqualität aufgrund von Nutzungsintensivierung oder -aufgabe (Fartmann 2017, Fartmann et al. 2021, Fischer & Lindenmayer 2007) sowie Isolation und verringerter Flächengröße (Fahrig 2003, Fartmann et al. 2021) gefährdet. Zudem bedrohen atmosphärische Stickstoffeinträge (Kurze et al. 2018, Wallis de Vries & Bobbink 2017) und der Klimawandel den Fortbestand der mitteleuropäischen Biodiversität in zunehmendem Maße (Fartmann et al. 2021, IPBES 2019).
Der wissenschaftliche Kenntnisstand über die Ursachen der Artenrückgänge hat sich insbesondere in den letzten Jahrzehnten stark verbessert (siehe etwa Übersichtsartikel von Cardoso et al. 2020 oder Wagner 2020). Zunächst scheint es nachvollziehbar, gegenwärtige Umweltveränderungen als mögliche Ursache für aktuelle Biodiversitätsverluste anzusehen. Neuere Studien zeigen aber, dass Aussterbeereignisse oft und mitunter deutlich zeitverzögert auf Umweltveränderungen folgen (zum Beispiel Löffler et al. 2020). Dieses Phänomen wird in der ökologischen Forschung als Aussterbeschuld (extinction debt ) bezeichnet (Abb. 1) (Haddad et al. 2015, Halley et al. 2014, Hylander & Ehrlén 2013, Kuussaari et al. 2009). Nachfolgend sollen das Konzept der Aussterbeschuld und dessen Bedeutung für den Naturschutz ausführlich vorgestellt werden.
2 Das Konzept der Aussterbeschuld und die Bedeutung für den Naturschutz
2.1 Definition der Aussterbeschuld
Der Begriff der Aussterbeschuld bezeichnet das Phänomen, dass Populationen und Arten nicht sofort nach Verschlechterung ihrer Lebensbedingungen verschwinden, sondern erst mit deutlicher zeitlicher Verzögerung (Hylander & Ehrlén 2013). „Schuld“ ist hier also nicht im Sinne einer Verantwortlichkeit zu verstehen, sondern als „Rückstand“ bzw. „Verzug“. Das Konzept der Aussterbeschuld lässt sich sowohl auf einzelne Arten als auch auf Artengemeinschaften anwenden (Hylander & Ehrlén 2013, Kuussaari et al. 2009, Lecoq et al. 2021, Ridding et al. 2021). Bezogen auf eine Art, die in einem bestimmten Gebiet mit mehreren lokalen Populationen oder als Metapopulation vorkommt (Fartmann 2017), bemisst sich die Höhe der Aussterbeschuld zum Zeitpunkt der Beobachtung an der Anzahl der noch existierenden Populationen im Vergleich zu den aufgrund der verringerten Umweltkapazität langfristig überlebensfähigen Populationen (Abb. 2). Demgegenüber resultiert die Aussterbeschuld einer Artengemeinschaft aus der Anzahl (bzw. dem Prozentsatz) von Arten, für welche die Bedingungen für ein langfristiges Überleben nicht mehr erfüllt sind und die deshalb kurz- bis mittelfristig aussterben werden.
Das Auftreten der Aussterbeschuld ist bislang vor allem bei Artengruppen mit langlebigen Individuen und langer Generationsdauer wie Gefäßpflanzen, Flechten, Pilzen und Wirbeltieren nachgewiesen worden (Abb. 1 und 3) (Kuussaari et al. 2009). Die wenigen Studien zu Insekten belegen aber, dass dieses Phänomen auch bei Heuschrecken, Käfern, Tagfaltern, Schnabelkerfen, Wildbienen und Zweiflüglern vorkommen kann (Bommarco et al. 2014, Kuussaari et al. 2009, Löffler et al. 2020, Otto et al. 2017, Sang et al. 2010, Triantis et al. 2010).
2.2 Gründe für das Auftreten einer Aussterbeschuld
Die Gründe für das Auftreten einer Aussterbeschuld können sehr unterschiedlich sein. Im einfachsten Fall pflanzt sich eine langlebige Art nicht mehr erfolgreich fort oder zumindest nicht in dem Umfang, wie es für den dauerhaften Fortbestand der Population erforderlich wäre. Die Langlebigkeit der Individuen ermöglicht somit trotz verschlechterter Umweltbedingungen das Weiterexistieren der Art für eine gewisse Zeit (Hylander & Ehrlén 2013, Kuussaari et al. 2009). Beispiele hierfür sind Wirbeltiere mit hoher Lebenserwartung, die entweder gar keinen Reproduktionsversuch mehr unternehmen oder ihren Nachwuchs nicht mehr erfolgreich aufziehen können. Dies ist zum Beispiel bei Populationen des sehr brutorttreuen und langlebigen Brachvogels (Numenius arquata ) in ehemals geeigneten, aber inzwischen degradierten Bruthabitaten der Fall (Abb. 4) (Bauer et al. 2005). Ein weiteres Beispiel für Arten mit langanhaltender Aussterbeschuld sind mehrjährige Pflanzen, bei denen die Keimung der Samen oder die Etablierung der Keimlinge unter den veränderten Umweltbedingungen stark erschwert oder gar nicht mehr möglich ist, etwa aufgrund fehlender Offenbodenstellen und einer immer dicker werden Streuschicht nach Nutzungsaufgabe (Abb. 1 und 3) (Ellenberg & Leuschner 2010, Kollmann et al. 2019).
Insekten weisen hingegen meist eine geringe Lebenserwartung auf. Daher scheinen hier andere Prozesse, die die Dynamik von Populationen und Metapopulationen beeinflussen, als Ursachen für die Aussterbeschuld von größerer Bedeutung zu sein (Hylander & Ehrlén 2013). Auf der Ebene einer einzelnen Population können zum einen Fitnessverluste, die durch eine zu geringe Populationsgröße und daher indirekt von der Verschlechterung der Lebensbedingungen verursacht sind, zum zeitverzögerten Erlöschen der Population führen. Hierzu zählen Inzuchteffekte, Gendrift und ganz allgemein der Verlust genetischer Variation („genetische Stochastizität“). Dadurch sinken Vitalität und Reproduktionserfolg der Individuen. Die Population wird anfälliger für Infektionen und Parasiten und verliert an Anpassungsfähigkeit an sich verändernde Umweltbedingungen. Außerdem steigt mit abnehmender Populationsgröße die Wahrscheinlichkeit, dass zufällig das Geschlechterverhältnis aus der Balance gerät („demografische Stochastizität“), was auch zu einer Verringerung der Reproduktionsrate führen kann. Zum anderen können kleine Populationen schon durch kleine zufällige Umweltveränderungen zum Aussterben gebracht werden („Umwelt-Stochastizität“). Ein Beispiel hierfür sind Populationsschwankungen aufgrund von Extremwetterereignissen oder wechselnder Witterung, wie sie auch für große und gesunde Insektenpopulationen charakteristisch sind. Bei reduzierter Populationsgröße fallen sie aber viel stärker ins Gewicht.
Schließlich können auch Prozesse, die auf der Ebene von Metapopulationen ablaufen, eine Aussterbeschuld verursachen (Hylander & Ehrlén 2013). In einer intakten Metapopulation wird das Aussterben lokaler Populationen durch Neu- und Wiederbesiedlung nicht besetzter Habitate ausgeglichen. Umweltveränderungen können den Austausch von Individuen zwischen den Lokalpopulationen einer Metapopulation beeinträchtigen. In der Folge sinkt die Wahrscheinlichkeit, mit der Habitate wiederbesiedelt werden. Dadurch kann die Rate, mit der lokale Populationen aussterben, die Rate der Populationsneugründungen übersteigen, sodass die Anzahl der noch existierenden Populationen stetig abnimmt.
Wie schnell dieses Schrumpfen der Metapopulation erfolgt, hängt stark von der Mobilität der Art und dem Fragmentierungsgrad ihrer Habitate ab. Es ist durchaus denkbar, dass die Aussterbeschuld einer Metapopulation über lange Zeit bestehen bleibt, wenn die Bilanz von Aussterbe- und Wiederbesiedlungsereignissen nur schwach negativ ist (Hylander & Ehrlén 2013). Simulationsrechnungen mit britischen Metapopulationen des Goldenen Scheckenfalters (Euphydryas aurinia ), deren Größe knapp unter dem für ein langfristiges Überleben erforderlichen Wert lag, ergaben Zeiträume von 15–126 Jahren bis zum vollständigen Aussterben der Metapopulationen (Abb. 5) (Bulman et al. 2007). In den Niederlanden wiesen van Strien et al. (2011) eine Aussterbeschuld bei der Rostbinde (Hipparchia semele ) nach (Abb. 6): Der Landnutzungswandel führte bei dieser Tagfalterart bereits ab den 1950er-Jahren zu abnehmenden Kolonisationsraten. Eine Schrumpfung des besiedelten Areals setzte aber erst ab den 1990er-Jahren ein.
2.3 Fallbespiel: Lebensgemeinschaften in Kalkmagerrasen
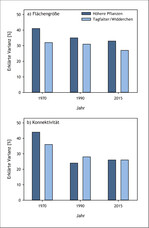
Wie die abnehmende Flächengröße von Kalkmagerrasen im Oberen Ahrtal (Eifel) zu einer Aussterbeschuld führt, konnte anhand von Gefäßpflanzen und Tagfaltern/Widderchen gezeigt werden (Löffler et al. 2020): Im Jahr 1970 gab es im Untersuchungsgebiet noch 420 ha Kalkmagerrasen. Bis 1990 nahm deren Fläche um mehr als 50 % auf 205 ha ab. Aufgrund intensiver Naturschutzmaßnahmen konnte der weitere Rückgang deutlich verlangsamt werden, sodass aktuell noch 175 ha an Kalkmagerasen vorhanden sind. Der Rückgang der Kalkmagerrasenfläche von 1970 bis 2015 führte folglich zu einer Verringerung der Größe und Konnektivität dieses Lebensraums (Abb. 7). Die aktuelle Artenvielfalt, sowohl der Pflanzen als auch der Schmetterlinge, war jedoch besser durch die Flächengröße und Konnektivität der Kalkmagerrasen im Jahr 1970 und abgeschwächt auch im Jahr 1990 erklärt als durch die aktuellen Bedingungen (Abb. 8). In den noch immer relativ großflächigen und gut vernetzten Kalkmagerrasen des Oberen Ahrtals besteht also bei beiden Taxa eine Aussterbeschuld. Sie wird erst beglichen sein, wenn die heutige Artenvielfalt in einem stärkeren Zusammenhang mit der aktuellen Flächenausdehnung und -konnektivität steht als mit den historischen Landschaftsbedingungen.
2.4 Synthese
Das Phänomen der Aussterbeschuld beschreibt ein zeitverzögertes Aussterben von Populationen oder Arten nach einer Umweltveränderung. Ein Zeitversatz zwischen dem Auftreten einer Umweltveränderung und dem Aussterben von Populationen oder Arten kann dazu führen, dass die Ursachen von Bestandsrückgängen nicht erkannt oder gar falsche Schlüsse gezogen werden. Dies ist oft bei schleichenden Veränderungen der Fall, beispielsweise der langsamen Abnahme der Habitatqualität. Im ungünstigsten Fall wird die eigentliche Ursache nicht als solche in Betracht gezogen, weil sie schon mehrere Jahre oder auch Jahrzehnte zuvor gewirkt hat. Deutlich weniger gravierenden Veränderungen oder Schwankungen der Umweltbedingungen, die in einem engeren zeitlichen Zusammenhang mit dem Aussterben der Population oder Art stehen, wird dagegen übermäßig viel Bedeutung beigemessen, obwohl sie oft nur der Tropfen waren, der das Fass zum Überlaufen brachte. Zudem kann die Aussterbeschuld dazu führen, dass der Erhaltungszustand einer Art übermäßig optimistisch eingeschätzt wird (Sang et al. 2010). Bleiben zum Beispiel nach Habitatverlust oder Habitatverschlechterung Restpopulationen einer Art zunächst noch bestehen, kann das darüber hinwegtäuschen, dass diese Populationen langfristig nicht überlebensfähig sind und irgendwann ebenfalls erlöschen werden, auch ohne weitere Verschlechterungen der Lebensbedingungen. Das Phänomen der Aussterbeschuld sollte zukünftig in der Naturschutzpraxis verstärkt berücksichtigt werden, um falsche Schlussfolgerungen zu vermeiden und rechtzeitig adäquate Maßnahmen umzusetzen.
Literatur
Bauer, H.-G., Bezzel, E., Fiedler, W. (2005): Das Kompendium der Vögel Mitteleuropas. Nonpasseriformes – Nichtsperlingsvögel. AULA, Wiebelsheim, 2. Aufl. Bommarco, R., Lindborg, R., Marini, L., Öckinger, E. (2014): Extinction debt for plants and flowervisiting insects in landscapes with contrasting land use history. Divers. Distrib. 20 (5), 591-599.
Bulman, C. R., Wilson, R. J., Holt, A. R., Bravo, L. G., Early, R. I., Warren, M. S., Thomas, C. D. (2007): Minimum viable metapopulation size, extinction debt, and the conservation of a declining species. Ecol. Appl. 17 (5), 1460-1473.
Cardoso, P., Barton, P. S., Birkhofer, K., Chichorro, F., Deacon, C., Fartmann, T., Fukushima, C. S., Gaigher, R., Habel, J., Hallmann, C. A., Hill, M., Hochkirch, A., Kwak, M. L., Mammola, S., Noriega, J. A., Orfinger, A. B., Pedraza, F., Pryke, J. S., Roque, F. O., Settele, J., Simaika, J. P., Stork, N. E., Suhling, F., Vorster, C., Samways, M. J. (2020): Scientists’ warning to humanity on insect extinctions. Biol. Conserv. 242, 108426.
Dirzo, R., Young, H. S., Galetti, M., Ceballos, G., Isaac, N. J. B., Collen, B. (2014): Defaunation in the Anthropocene. Science 345 (6195), 401-406.
Eichenberg, D., Bowler, D. E., Bonn, A., Bruelheide, H., Grescho, V., Harter, D., Jandt, U., May, R., Winter, M., Jansen, F. (2021): Widespread decline in Central European plant diversity across six decades. Glob. Change Biol. doi: 10.1111/gcb.15447
Ellenberg, H., Leuschner, C. (2010): Vegetation Mitteleuropas mit den Alpen. Verlag Eugen Ulmer, Stuttgart, 6. Aufl.
Fahrig, L. (2003): Effects of habitat fragmentation on biodiversity. Annu. Rev. Ecol. Evol. Syst. 34, 487- 515.
Fartmann, T. (2017): Überleben in fragmentierten Landschaften. Grundlagen für den Schutz der Biodiversität Mitteleuropas in Zeiten des globalen Wandels. Naturschutz Landschaftspl. 49 (9), 277-282.
–, Jedicke, E., Stuhldreher, G., Streitberger, M. (2021): Insektensterben in Mitteleuropa – Ursachen und Gegenmaßnahmen. Verlag Eugen Ulmer, Stuttgart-Hohenheim (im Druck).
–, Poniatowski, D., Stuhldreher, G., Streitberger, M. (2019): Insektenrückgang und -schutz in den fragmentierten Landschaften Mitteleuropas. Natur Landschaft 94 (6/7), 261-270.
Fischer, J., Lindenmayer, D. B. (2007): Landscape modification and habitat fragmentation: a synthesis. Glob. Ecol. Biogeogr. 16, 265-280.
Gatter, W. (2000): Vogelzug und Vogelbestände in Mitteleuropa. 30 Jahre Beobachtung des Tagzugs am Randecker Maar. AULA, Wiebelsheim.
Haddad, N. M., Brudvig, L. A., Clobert, J., Davies, K. F., Gonzalez, A., Holt, R. D., Lovejoy, T. E., Sexton, J. O., Austin M. P., Collins, C. D., Cook, W. M., Damschen, E. I., Ewers, R. M., Foster, B. L., Jenkins, C. N., King, A. J., Laurance, W. F., Levey, D. J., Margules, C. R., Melbourne, B. A., Nicholls, A. O., Orrock, J. L., Song, D.-X., Townshend, J. R. (2015): Habitat fragmentation and its lasting impact on Earth’s ecosystems. Sci. Adv. 2015: e1500052
Halley, J. M., Sgardeli, V. & K. A. Triantis (2014): Extinction debt and the species–area relationship: a neutral perspective. Glob. Ecol. Biogeogr. 23 (1), 113-123.
Hylander, K., Ehrlén, J. (2013): The mechanisms causing extinction debts. Trends in Ecology & Evolution 28 (6), 341–346.
IPBES (The Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services) (2019): Summary for Policymakers of the Global Assessment Report on Biodiversity and Ecosystem Services of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services. IPBES secretariat, Bonn.
Kollmann, J., Kirmer, A., Tischew, S., Hölzel, N., Kiehl, K. (2019): Renaturierungsökologie. Springer, Berlin.
Kurze, S., Heinken, T., Fartmann, T. (2018): Nitrogen enrichment in host plants increases the mortality of common Lepidoptera species. Oecologia 188, 1227-1237.
Kuussaari, M., Bommarco, R., Heikkinen, R., Helm, A., Krauss, J., Lindborg, R., Ockinger, E., Pärtel, M., Pino, J., Rodà, F., Stefanescu, C., Teder, T., Zobel, M., Steffan-Dewenter, I. (2009): Extinction debt: a challenge for biodiversity conservation. Trends Ecol. Evol. 24 (10), 564-571.
Lecoq, L., Ernoult, A., Mony, C. (2021): Past landscape structure drives the functional assemblages of plants and birds. Sci Rep. 11, 3443.
Löffler, F., Poniatowski, D., Fartmann T. (2020): Extinction debt across three taxa in well-connected calcareous grasslands. Biol. Conserv. 246, 108588.
Otto, R., Garzón-Machado, V., del Arco, M., Fernández-Lugo, S., de Nascimento, L., Oromí, P., Báez, M., Ibáñez, M., Alonso, M. R., Fernández-Palacios, J. M. (2017): Unpaid extinction debts for endemic plants and invertebrates as a legacy of habitat loss on oceanic islands. Divers. Distrib. 23 (9), 1031-1041.
Poschlod, P. (2017): Geschichte der Kulturlandschaft. Verlag Eugen Ulmer, Stuttgart, 2. Aufl.
Ridding, L. E., Newton, A. C., Keith, S. A., Walls, R. M., Diaz, A., Pywell, R. F., Bullock, J. M. (2021): Inconsistent detection of extinction debts using different methods. Ecography 44, 33-43.
Rockström, J., Steffen, W., Noone, K., Persson, A., Chapin, F. S., Lambin, E. F., Lenton, T. M., Scheffer, M., Folke, C., Schellnhuber, H. J., Nykvist, B., Wit, C. A. de, Hughes, T., van der Leeuw, S., Rodhe, H., Sörlin, S., Snyder, P. K., Costanza, R., Svedin, U., Falkenmark, M., Karlberg, L., Corell, R. W., Fabry, V. J., Hansen, J., Walker, B., Liverman, D., Richardson, K., Crutzen, P., Foley, J. A. (2009): A safe operating space for humanity. Nature 461, 472-475
Sang, A., Teder, T., Helm, A., Pärtel, M. (2010): Indirect evidence for an extinction debt of grassland butterflies half century after habitat loss. Biol. Conserv. 143 (6), 1405-1413.
Triantis, K. A., Borges, P. A. V., Ladle, R. J., Hortal, J., Cardoso, P., Gaspar, C., Dinis, F., Mendonça, E., Silveira, L. M. A., Gabriel, R., Melo, C., Santos, A. M. C., Amorim, I. R., Ribeiro, S. P., Serrano, A. R. M., Quartau, J. A., Whittaker, R. J. (2010): Extinction debt on oceanic islands. Ecography 33 (2), 285-294.
van Strien, A. J., van Swaay, C. A. M., Kéry, M. (2011): Metapopulation dynamics in the butterfly Hipparchia semele changed decades before occupancy declined in the Netherlands. Ecol. Appl. 21 (7), 2510-2520.
Wagner, D. L. (2020): Insect declines in the Anthropocene. Ann. Rev. Entomol. 65, 457–480.
Wallis de Vries, M. F., Bobbink, R. (2017): Nitrogen deposition impacts on biodiversity in terrestrial ecosystems: Mechanisms and perspectives for restoration. Biol. Conserv. 2012, 387-389.
Fazit für die Praxis
- Ein Zeitversatz zwischen dem Auftreten einer Umweltveränderung und dem Aussterben von Arten (Aussterbeschuld,extinction debt ) kann dazu führen, dass die Ursachen von Bestandsrückgängen nicht erkannt werden oder gar falsche Schlüsse für den Naturschutz gezogen werden.
- Dies ist oft bei schleichenden Veränderungen der Fall, beispielsweise der langsamen Abnahme der Habitatqualität.
- Im ungünstigsten Fall wird die eigentliche Ursache nicht als solche in Betracht gezogen, weil sie schon mehrere Jahre oder auch Jahrzehnte zuvor gewirkt hat.
- Bleiben zum Beispiel nach Habitatverlust oder -verschlechterung Restpopulationen einer Art über mehrere Jahre bestehen, kann das darüber hinwegtäuschen, dass diese Populationen langfristig nicht lebensfähig sind und irgendwann ebenfalls erlöschen werden.
- Das Phänomen der Aussterbeschuld sollte zukünftig in der Naturschutzpraxis verstärkt berücksichtigt werden, um falsche Schlussfolgerungen zu vermeiden und rechtzeitig adäquate Maßnahmen umzusetzen.
Kontakt

Prof. Dr. Thomas Fartmann ist Ökologe und Biogeograph. Er leitet die Abteilung Biodiversität und Landschaftsökologie an der Universität Osnabrück. Forschungsschwerpunkte sind unter anderem Auswirkungen des rezenten Landnutzungs- und Klimawandels auf die Biodiversität, Störungsökologie und Renaturierungsökologie. Veröffentlichung von bislang mehr als 200 wissenschaftlichen Publikationen.
Dr. Gregor Stuhldreher studierte und promovierte in Landschaftsökologie. Seit 2016 Wissenschaftlicher Mitarbeiter der Abteilung Biodiversität und Landschaftsökologie der Universität Osnabrück. Forschungsaktivitäten in verschiedenen Bereichen der Biozönologie und Renaturierungsökologie. Schwerpunkte sind die Auswirkungen des Landnutzungs- und des Klimawandels sowie die Entwicklung von Konzepten zum Monitoring von Insektenpopulationen.
Dr. Merle Streitberger ist Landschaftsökologin und beschäftigt sich seit 2012 mit diversen Forschungsprojekten im Bereich der Biodiversitätsforschung. Schwerpunkte liegen in der Entomologie und Vegetationsökologie. Seit 2016 tätig in der Arbeitsgruppe von Thomas Fartmann an der Universität Osnabrück. Aktuelle Forschungsarbeiten umfassen die Konzipierung des bundesweiten Insektenmonitorings sowie die Renaturierungsökologie.
> merle.streitberger@uni-osnabrueck.de
Franz Löffler, M.Sc. Landsch.-ökol. , Wissenschaftlicher Mitarbeiter in der Abteilung für Biodiversität und Landschaftsökologie, Universität Osnabrück.
Dr. Dominik Poniatowski, Wissenschaftlicher Mitarbeiter in der Abteilung für Biodiversität und Landschaftsökologie, Universität Osnabrück.
Von Thomas Fartmann, Gregor Stuhldreher, Merle Streitberger, Franz Löffler und Dominik Poniatowski
Eingereicht am 19.01. 2021, angenommen am 21. 03. 2021
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen


















Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.