Urbane Artenvielfalt fördern
Abstracts
In einer ersten Studie wurde die Arthropodenvielfalt in den Baumkronen heimischer und gebietsfremder Stadtbäume vergleichend untersucht. Alle Baumarten wiesen einen unerwartet hohen Individuen- und Artenreichtum auf. Auf den heimischen Baumarten wurden deutlich mehr Individuen gefangen, allerdings nicht in allen Arthropodentaxa. In der Anzahl der Arten verschiedener Taxa unterschieden sich die heimischen Baumarten nicht von ihren südosteuropäischen Verwandten, während sich für die Biodiversität (Shannon Hs) kein einheitliches Bild ergab. 42 % der Insektenarten dominanter Taxa waren sowohl auf heimischen als auch auf gebietsfremden Bäumen zu finden, 32 % nur auf heimischen und 26 % nur auf gebietsfremden Baumarten. Die Grünstreifen der Bäume erwiesen sich als wichtiger Teillebensraum für die meisten Wildbienenarten sowie für Zikaden und viele andere Insekten. Zur Förderung der urbanen Arthropodenvielfalt sind nach vorliegenden Ergebnissen entsprechend angelegte Misch-Alleen aus heimischen und an klimatische Veränderungen gut angepassten südosteuropäischen Baumarten zu empfehlen.
Promotion of urban biodiversity – Arthropod diversity of native and non-native urban trees
This is a first study comparing arthropod diversity in the crowns of native and non-native urban trees. All tree species showed an unexpectedly high number of arthropod individuals and species. On native trees a significantly higher number of arthropods was caught, but not in all analyzed taxa. Native and related south-east European tree species did not differ in their arthropod species richness, while no consistent pattern was found for the biodiversity (Shannon Hs) of different taxa. 42% of the insect species of dominant taxa were found on both native and non-native trees, 32% only on native trees and 26% only on non-native trees. Lawn strips between the trees turned out to be an essential habitat for most of the wild bee species, cicadas and many other insects. According to the present findings, mixed alleys of native and southeast-European tree species that are well adapted to climate changes should be planted to promote urban arthropod diversity.
- Veröffentlicht am
1 Einleitung
Die zunehmende Urbanisierung mit ihrer Nachverdichtung und steigenden Flächenversiegelung sowie der fortschreitende Klimawandel führen zu einer immer stärkeren Aufheizung der innerstädtischen Bereiche. Um diesem UHI- („urban heat island“-)Effekt (Collier2006) entgegenzuwirken und das urbane Mikroklima zu verbessern, kommt dem urbanen Grün – insbesondere Bäumen – eine wesentliche Bedeutung zu: Sie dienen als Schattenspender, „Klimaanlagen“ durch Kühlungseffekte und CO2-Fixierer. Außerdem erbringen sie eine Reihe weiterer Ökosystemleistungen wie Feinstaubfilterung und Lärmminderung, sie sind Lebensraum für Fauna und Flora und stellen ganz allgemein eine Steigerung unserer Lebensqualität in städtischen Quartieren dar. Bäumen kommt durch ihre Dreidimensionalität und Größe vor allem im Straßenbereich eine besondere Bedeutung zu.
Grundvoraussetzung für die Erfüllung von Ökosystemleistungen ist die Pflanzengesundheit: Je gesünder Pflanzen sind, desto stärker können sie den negativen Folgen der UHI-Effekte und der Klimaerwärmung entgegenwirken. Typisch heimische Stadtbaumarten wie Bergahorn, Sommer- und Winterlinde geraten jedoch zunehmend an die Grenzen ihrer lokalen Anpassungsfähigkeit. Sie leiden immer stärker unter Trockenstress und zeigen sich entsprechend anfälliger für Schädlinge und Krankheiten (Kehr & Rust2007, Roloffet al. 2008). Eine weitere Zunahme der Stresssituation ist aufgrund der Vorhersagen regionaler Klimamodelle zu erwarten; „Jahrhundertsommer“ wie 2015 und 2018 werden in absehbarer Zukunft nicht mehr die Ausnahme sein, sondern regelmäßig auftreten (Rauh & Paeth2011). Dennoch wird seit der Novellierung des Bundesnaturschutzgesetzes 2010 immer wieder, vor allem auch von Seiten der Naturschutzverbände und Umweltbehörden, gefordert, dass auch in Zeiten des Klimawandels im städtischen Bereich nur heimische Baumarten verwendet werden sollten. Gebietsfremde Baumarten, so wird oft argumentiert, seien artenärmer und böten der heimischen Tierwelt keinen geeigneten Lebensraum.
Entsprechende vergleichende Untersuchungen zur Artenvielfalt in den Kronen von Bäumen an städtischen Straßenstandorten, die diese Einschätzung mit Fakten belegen könnten, liegen bisher nicht vor. Um die Diskussion zu versachlichen und Umwelt- und Naturschutzbehörden Fakten an die Hand geben zu können, wurde in vorliegender Studie die Arthropodenvielfalt auf nahverwandten heimischen und gebietsfremden Baumarten vergleichend untersucht.
2 Fragestellung und Versuchsdesign
Die Untersuchungen fanden im Rahmen des Forschungsprojekts „Stadtgrün 2021“ der Bayerischen Landesanstalt für Weinbau und Gartenbau statt. Hierbei handelt es sich um ein langfristig angelegtes Stadtbaumprojekt, in dem seit 2010 mittlerweile 30 Baumarten, vorwiegend rein kontinentaler Herkunft, auf ihre Stadtklimaresilienz in verschiedenen bayerischen Städten, darunter Würzburg, getestet werden (Böll2017). Das Projekt hat das Ziel, das stark eingeschränkte Repertoire städtischer Baumarten zu erweitern und regional angepasste Straßenbaumsortimente herauszuarbeiten.
2017 befanden sich die Versuchsbäume im achten Standjahr und hatten Kronengrößen entwickelt, die faunistische Untersuchungen zu diesem Thema sinnvoll erscheinen ließen. Daher wurde in Würzburg die Arthropodenvielfalt der Kronenfauna dreier heimischer Baumarten mit der Fauna dreier nahverwandter südosteuropäischer Baumarten verglichen. Folgende Fragestellungen standen im Mittelpunkt der Untersuchungen:
- Lebt in den Kronen heimischer Straßenbaumarten eine höhere Anzahl von Arthropoden als auf verwandten südosteuropäischen Baumarten?
- Zeigen heimische Straßenbaumarten eine höhere Artenvielfalt in der Kronenfauna als verwandte südosteuropäische Arten?
- Unterscheiden sich die Arthropodengemeinschaften auf heimischen und nah verwandten gebietsfremden Baumarten?
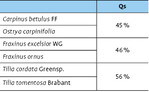
Die drei untersuchten Baumartenpaare sind in Tab. 1 dargestellt.
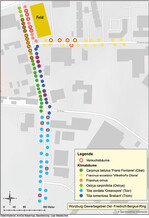
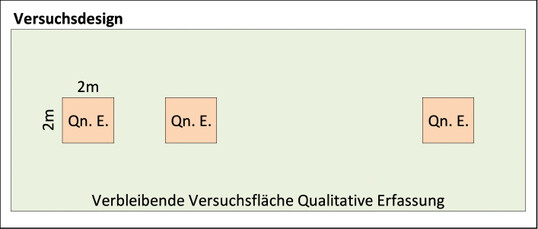
Alle Bäume waren von vergleichbarem Alter und Wuchs und standen unter vergleichbaren klimatischen Bedingungen in unmittelbarer Nachbarschaft (< 750 m) am Straßenrand im Industriegebiet Ost in Würzburg in Grünstreifen (Abb. 1 und 2). Bis auf die Eschen befanden sich alle Versuchsbaumarten im bebauten Bereich. Beide Eschenarten grenzten an ein bewirtschaftetes Getreidefeld, das an den Rändern nur eine sehr geringe Ruderalflora aufwies.
Es wurden folgende ökologische Standardmethoden zum Fang der Insekten und Spinnen verwendet: In jedem Baum wurden in der mittleren Krone (von außen nicht sichtbar; N- bzw. S-Seite) zwei Luft-Eklektoren (Fensterfallen) und eine Gelbtafel aufgehängt. An den Fallenwechseltagen wurden zum Fang von Insektenlarven und Spinnen standardisierte Klopfproben durchgeführt. Die Probennahmen wurden von April bis Oktober 2017 in zweiwöchigem Abstand über die gesamte Vegetationsperiode durchgeführt. Die gesammelten Arthropoden wurden gezählt und taxonspezifisch bis auf Familienniveau vorsortiert. Bestimmte funktionelle Gruppen wurden von Spezialisten bis zur Art bestimmt: Pflanzensauger und -kauer (Zikaden, Wanzen, Blatt- und Rüsselkäfer), Bestäuber (Wildbienen) und Spinnen (Räuber). Bei den Wanzen ist die Bestimmung der artenreichen Familien der Miridae und Anthocoridae noch nicht abgeschlossen.
Die Biodiversität der Baumkronenfauna wurde auf Basis von Artenzahlen und Shannon-Diversitätsindices ermittelt. Der Shannon-Diversitätsindex bezieht neben der Artenzahl auch die Verteilung der Individuen auf die Arten mit ein. Shannon-Diversitätsindices wurden mit dem Shannon-Diversitäts-t-Test verglichen (PAST Version 3.19). Die Vergleiche basieren auf der Annahme, dass jede Art des beobachteten Artenspektrums auf allen Bäumen die gleiche Nachweiswahrscheinlichkeit besitzt, was trotz der engen Nachbarschaft aller Versuchsbäume durch die heterogene Umgebung nur bedingt gegeben sein dürfte. Da es sich jedoch um paarweise Vergleiche der Schwesternbaumarten handelt, die wie die Eschen beide am gleichen Feld bzw. bis auf einen Teil der Winterlinden jeweils auf der gleichen Straßenseite stehen und maximal wenige hundert Meter voneinander entfernt sind, dürften die Abweichungen relativ geringfügig sein. Zur Berechnung der Faunenähnlichkeit der verwandten Schwesternbaumarten wurde der Ähnlichkeitsqotient QsnachSörensenverwendet (Mühlenberg1993).
3 Ergebnisse
Über den Erfassungszeitraum wurden mehr als 94.000 Arthropoden gesammelt. Davon wurden über 70.000 auf den Gelbtafeln gezählt. Aufgrund der hohen Fängigkeit ist die Auswertung der Gelbtafeln noch nicht abgeschlossen. Deshalb wird im Weiteren ausschließlich auf die Ergebnisse der Eklektor- und Klopfproben eingegangen.
Insgesamt wurden mit diesen beiden Methoden 23.883 Arthropoden aus 18 Ordnungen und 118 Familien gefangen. Es dominierten die Dipteren mit 41 % aller Individuen, gefolgt von Hemipteren (18 %), Coleopteren (16 %) und Hymenopteren (14 %). Die räuberischen Spinnen (5 %) sind unterrepräsentiert, da sie über Klopfproben nur an den jeweiligen Fallenwechseltagen erfasst wurden. Alle weiteren Ordnungen waren mit weniger als 5 % der Individuen vertreten. Insgesamt wurden in den funktionellen Gruppen 254 Arthropodenarten bestimmt.
3.1 Arthropodenabundanz in den Baumkronen
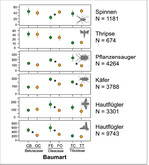
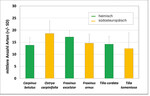
Alle Baumarten wiesen hohe Arthropodenabundanzen auf, wobei die heimischen Baumarten im Vergleich zu den kontinentalen Verwandten signifikant individuenreicher waren (lineares gemischtes Modell, p < 0,001). „Spitzenreiter“ mit über 6.000 Individuen war Fraxinus excelsior ‚Westhofs Glorie‘, mit deutlicher Dominanz der Dipteren.
Beim Paarvergleich der Schwesterbaumarten und einer differenzierten Betrachtung der dominanten Taxa weisen die heimischen Baumarten aber nicht durchgängig höhere Abundanzen auf: So bestehen bei Hainbuche und Hopfenbuche so gut wie keine Unterschiede in den Individuenzahlen – nur die Gruppe der Dipteren ist auf der Hainbuche stärker vertreten (Abb. 3). Bei den Linden ergeben sich nur bei den Pflanzensaugern und den Käfern signifikante Unterschiede (Abb. 3), was auf den starken Blattlausbefall der Winterlinden und die entsprechend stärker vertretenen räuberischen Marienkäfer zurückzuführen ist).
3.2 Diversität ausgewählter dominanter Insektengruppen
3.2.1 Zikadenfauna der Baumkronen
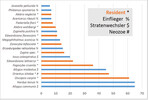
Insgesamt wurden 58 Zikadenarten mit 555 Individuen auf den untersuchten Bäumen gefunden. Von diesen waren fast zwei Drittel (37 Arten, 177 Individuen) sogenannte Einflieger, die entweder aktiv in den Kronenraum eingeflogen sind oder passiv eingeweht wurden (Nickel2008, Abb. 4).
Einflieger können aus der Krautschicht des Pflanzstreifens der Bäume oder von anderen Gehölzen kommen, auf denen sie sich reproduzieren. Acht weitere Arten (mit 141 Individuen) sind Stratenwechsler und legen ihre Eier im Boden oder in der Krautschicht ab. Sie begeben sich erst im Larval- oder Adultstadium in Bäume und sind dabei nicht oder nur wenig baumartenspezifisch. 13 Arten (22 % von 58) mit 229 Individuen (41 % von 555) pflanzen sich auf den untersuchten Baumarten auch fort (Residente). Insgesamt wurden zwei Neozoenarten gefunden: Orientus ishidae (Mats.) wurde auf allen heimischen wie auch südosteuropäischen Baumarten gefangen. Die an Gehölzen polyphage Art kommt seit Beginn des Jahrhunderts in Deutschland vor (Nickel2008). Die zweite Art, Penestragania apicalis (Osb. & Ball), wurde erst vor Kurzem erstmals in Deutschland und zugleich Europa nachgewiesen. Sie lebt monophag an Gleditsia triacanthos (Nickelet al. 2013), wurde hier aber mit einem Individuum auf Fraxinus ornus gefangen.
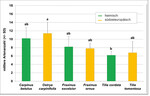
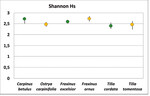
Es bestand kein signifikanter Unterschied in der lokalen Vielfalt der Zikaden auf den heimischen Baumarten und ihren südosteuropäischen Schwesternarten (Abb. 5). Beim Vergleich aller Baumarten untereinander ergab sich lediglich ein signifikanter Unterschied zwischen der südosteuropäischen Hopfenbuche Ostrya carpinifolia und der heimischen Winterlinde Tilia cordata , auf der die wenigsten Zikadenarten vorkamen (Kruskal Wallis ANOVA p = 0,02, Abb. 5).
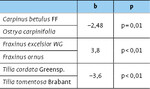
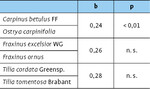
Vergleicht man die Diversität der Zikadenfauna zwischen heimischen und südosteuropäischen Baumarten, so unterscheiden sich sämtliche Schwesternarten signifikant voneinander (Tab. 2), wobei teils die heimischen ( Fraxinus excelsior WG / Frax inus ornus ), teils die südosteuropäischen Arten ( Carpinus betulus FF / Ostrya carpinifolia, Tilia cordata Greenspire / Tilia tomentosa Brabant) eine höhere Biodiversität aufweisen (Abb. 6, Tab. 2).
Hain- und Hopfenbuche bzw. Gemeine Esche und Blumenesche zeigen fast identische Artenüberlappungswerte und unterscheiden sich geringfügig von den ähnlicheren Zikadengemeinschaften der Winter- und Silberlinde (Tab. 3).
3.2.2 Wildbienenfauna der Baumkronen
Insgesamt wurden 3.301 Hymenopteren (42 Familien) gefangen, deren jahreszeitliches Auftreten mit mehreren Abundanzmaxima auf die unterschiedlichen Lebenszyklen und Flugzeiten der verschiedenen Bienenarten zurückzuführen ist (Abb. 7).
Insgesamt wurden 57 Wildbienenarten in den Baumkronen gefunden, ein Zehntel aller in Deutschland gelisteten Arten. Beim Vergleich der Wildbienenarten auf heimischen und südosteuropäischen Bäumen ergaben sich keine signifikanten Unterschiede in der Artenvielfalt (Kruskal Wallis ANOVA p = 0,29, Abb. 8). 90 % der Arten sind polylektische Bodennister, für die somit Grünstreifen unter Bäumen wichtige urbane Nisthabitaten darstellen (Scheuchl & Willner2016, Westrich2018, Wiesbauer2017). Neozoen waren unter den erfassten Wildbienenarten nicht vertreten.
Vergleicht man die Shannon-Diversität der Wildbienen auf heimischen und südosteuropäischen Baumarten, so zeigt die Hainbuche eine signifikant höhere Biodiversität als die Hopfenbuche (Shannon-Diversity t-Test, p < 0,01), während die anderen beiden Schwesternbaumarten sich nicht signifikant voneinander unterscheiden (Abb. 9, Tab. 4).
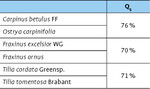
Alle Schwesterbaumarten zeigen einheitliche Artenüberlappungswerte um die 70 % (Tab. 5), was auf ähnliche Wildbienengemeinschaften hinweist.
3.3 Vergleich der Artenvielfalt auf heimischen und südosteuropäischen Baumarten
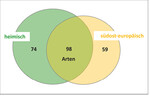
Insgesamt hat sich in der bisherigen Auswertung gezeigt, dass sich die südosteuropäischen Baumarten in der Artenvielfalt der Arthropoden nicht von ihren verwandten heimischen Baumarten unterscheiden. Betrachtet man nun alle Arten der bisher vorgestellten Tiergruppen und ordnet sie entsprechend ihres Auftretens nur den heimischen, nur den südosteuropäischen oder beiden Baumartengruppen zu, so zeigt sich, dass die überwiegende Anzahl zur Kronenfauna beider Baumartengruppen gehört (42 % Artenidentität), ein Drittel nur auf heimischen Bäumen vorkam und ein Viertel ausschließlich auf den südosteuropäischen Baumarten zu finden war (Abb. 10).
4 Urbane Insektenvielfalt durch Artenreichtum der Stadtbaumarten
Nach einer als „Krefelder Studie“ bekannt gewordenen Publikation vonHallmannet al. (2017), bei der über 23 Jahre lang an 63 Standorten mit Schutzstatus Insektenmonitoring betrieben wurde, ging die Biomasse von Insekten in der freien Landschaft teilweise um bis zu 75 % zurück. Ähnlich dramatische Verluste in der Biomasse wurde für Zikadenpopulationen auf geschützten Trockenrasen Ostdeutschlands (54 %) und für genutztes Feuchtgrünland in Niedersachsen (78 %) über einen Zeitraum von 40 bis 60 Jahren nachgewiesen (Schuchet al. 2019). Für verschiedene Insektentaxa ist ein dramatischer Artenschwund in der Agrarlandschaft belegt (Habelet al. 2019, Sánchez-Bayoet al.2019). Dem Insektenrückgang im ländlichen Raum stehen Studien gegenüber, die urbane Lebensräume als Insektenrefugien erkennen lassen, mit vergleichbarer (Sattleret al. 2011) oder höherer Artenvielfalt als im Umland (Baldocket al. 2015,Hallet al. 2017). Als Gründe dafür wird diskutiert, dass in Städten keine Pestizide eingesetzt werden dürfen und urbane Habitate eine hohe Heterogenität an ungleichmäßig verteilten, kleinräumigen Lebensräumen („urban mosaic“) aufweisen (Sattleret al. 2011).
Die vorliegende Untersuchung in Würzburg zur Arthropodenvielfalt in den Kronen von heimischen und mit diesen verwandten gebietsfremden Stadtbaumarten, die erste Fallstudie ihrer Art, überrascht durch die hohe Anzahl an Individuen und Arten, die auf allen Versuchsbaumarten gefunden wurden, obwohl sich untersuchten Bäume derzeit noch im Jungbaumstadium befanden.
Auf den heimischen Baumarten wurden deutlich mehr Insekten gefangen als auf den nahverwandten südosteuropäischen Arten. Zu einem ähnlichen Ergebnis kommenProcheset al. (2008) beim Vergleich der Kronenfauna heimischer und gebietsfremder Waldbäume. Die Abundanzen in unserer Untersuchung werden allerdings stark durch die dominante Insektengruppe der Fliegen und Mücken (Diptera) geprägt und gelten nicht für alle Taxa oder Baumartenpaare.
Neben hohen Abundanzen wurden auch erstaunlich hohe Familien- und Artenzahlen in den einzelnen Taxa mit z. B. über 40 Käferfamilien gefunden. So lag die Anzahl der Zikadenarten im gleichen Bereich wie vonOlthoff(1985) für die zwei heimischen Straßenbaumarten Quercus robur (n = 23) und Tilia × europaea (n = 18) in Hamburg beschrieben, deren Kronen er in zwei Jahren je dreimal über die Saison mit einem Insektizid begast hatte. Die von ihm ermittelten Biodiversitätsindices waren mit Hs < 2,0 durchweg niedriger als in unserer Studie, bei der die erfassten Zikadenindividuen gleichmäßiger auf die Arten verteilt waren und keine Art dominant auftrat.
Dass gebietsfremde Baumarten kein geeigneter Lebensraum für die heimische Fauna seien, hat sich zumindest für die von uns untersuchten südosteuropäischen Baumarten nicht bestätigt, deren Insekten- -Diversität sich nicht von der ihrer heimischen Schwesternarten unterscheidet. Vergleicht man die Biodiversität der Schwesternbaumarten anhand der -Diversität, so ergibt sich kein eindeutiges Bild: Bei den Zikaden ist die Biodiversität auf den südosteuropäischen Arten höher (Ausnahme: Eschen), während die Hymenopteren auf der Hainbuche gegenüber der Hopfenbuche eine höhere Biodiversität zeigen, sich die anderen beiden Schwesternbaumarten aber in der Biodiversität nicht unterscheiden.
Für die Beurteilung von Biodiversität ist eine differenzierte Betrachtung der einzelnen Insektengruppen wichtig. Auch sollten möglichst alle erfassten Insektenordnungen einbezogen werden (was aber gerade bei den dominanten Dipteren sehr schwierig ist, die als „Vogelfutter“ zudem eine wichtige Funktion in der urbanen Nahrungskette haben). Auch ein Fokus auf Gildenebene kann zur Erklärung von Unterschieden in der Artenähnlichkeit beitragen. So liegt bei Pollensammlern (Wildbienen) mit > 70 % eine wesentlich höhere Übereinstimmung zwischen den jeweiligen Schwesterbaumarten vor als bei den phytophagen Pflanzensaugern (Zikaden) mit > 40 %. Gut ein Drittel der Zikadenarten sind mono- oder oligophag an eine entsprechende Baumart gebunden, während die Baumart für die polylektischen Bienen eine weitaus geringere Rolle spielen dürfte (s. u.).
Vergleicht man nun den Anteil der Insektenarten, die nur auf den heimischen oder den südosteuropäischen Baumarten vorkamen, so zeigt sich, dass über die Hälfte der Arten nur auf einer der beiden Baumgruppen zu finden war, d. h., dass die höchste Biodiversität der Baumkronenfauna nur durch eine gemischte Anpflanzung der untersuchten Baumarten erreicht werden kann.Buchholzet al. (2015) führten in einem Berliner Stadtwald eine vergleichende Untersuchung bodenlebender Arthropoden einer heimischen und einer gebietsfremden Baumart (Birke vs. Robinie) durch. Sie stellten fest, dass sich die beiden Baumarten in der Artenvielfalt der Laufkäfer- und Spinnenarten nicht unterschieden, die Laufkäfergemeinschaften aber unterschiedlich zusammengesetzt waren. Auch in dieser Studie war die Artenvielfalt unter gemischten Baumbeständen am höchsten. Zu ähnlichen Ergebnissen kamenHartleyet al. (2010) in einer nordamerikanischen Baumschule, in der die Kronenfauna einer gebietsfremden Baumart mit der dreier heimischer Baumarten verglichen wurde: Die untersuchte gebietsfremde Baumart unterschied sich nicht in der Artenvielfalt, aber deutlich in der Zusammensetzung der Arthropodengemeinschaft von den drei heimischen Baumarten.
Mit 57 Wildbienenarten war die Artenvielfalt in den Kronen unserer Versuchsbäume unerwartet hoch. Naheliegend ist, dass Wildbienen dort außerhalb der Blütezeit Schatten und Feuchtigkeit während extremer Temperaturen finden. Essenziell für das Auftreten der hohen Wildbienenvielfalt über die gesamte Vegetationsperiode ist jedoch der Grünstreifen unter den Bäumen, da über 90 % der Arten Pollengeneralisten sind und im offenen Boden ihre Nester anlegen (Westrich2018,Wiesbauer2017). Auch viele andere Insekten sind auf den Grünstreifen als Teillebensraum angewiesen, z. B. Grabwespen(Honomichl1998, Witt1998), ein beträchtlicher Anteil der Zikaden- und Wanzenarten (Mühletaleret al. 2018,Nickel2008,Schmolkeet al. 2006,Wachmannet al. 2004,2006,2007,2008,2018) oder Käfer wie die Cryptophagiden (Schimmelkäfer), deren Larven Substratfresser sind (Willner2013).
All diese Arten wären nicht erfasst worden, wenn unsere Versuchsbäume in einzelnen Baumgruben gestanden hätten. Die Biodiversität der Kronenfauna hängt nach unseren Ergebnissen in hohem Maß vom Grünstreifen ab, der somit Teil des „Gesamtlebensraums Stadtbaum“ ist.
5 Fazit und Ausblick
Per se sind gebietsfremde Baumarten nicht abzulehnen, da sie häufig eine höhere Stadtklimaresilienz und Vitalität als heimische Stadtbäume aufweisen (Böll2017). Die südosteuropäischen Baumarten unserer Studie tragen ebenso wie ihre nah verwandten heimischen Schwesternarten zur urbanen Artenvielfalt bei.
Urbane Biodiversität profitiert somit von gemischten Alleen, im Übrigen eine der wichtigsten Maßnahmen, um der Ausbreitung von zunehmend häufiger auftretenden neuen Pflanzenkrankheiten und Schädlingen entgegenzuwirken (Jactel & Brockerhoff2007). Grünstreifen (statt einzelne Baumgruben) dienen als wichtiger Teillebensraum vieler baumlebender Insekten.
In der Folge sollen weitere gebietsfremde Baumarten des Stadtbaumprojekts „Stadtgrün 2021“ vergleichend auf ihre ökologische Wertigkeit untersucht werden.
Dank
Wir danken dem Bayerischen Staatsministerium für Ernährung, Landwirtschaft und Forsten für die langjährige Förderung des Projektes „Stadtgrün 2021“ und dem Bayerischen Staatsministerium für Umwelt und Verbraucherschutz für die Förderung unserer Biodiversitätsuntersuchungen an Stadtbäumen, die wir unter Koordination des Zentrums für Stadtnatur und Klimaanpassung (ZSK) der TU München durchführten. Unser besonderer Dank gilt allen Taxonomen und studentischen Hilfskräften, die wesentlich zum Gelingen der Studie beigetragen haben.
Literatur
Baldock, K. C. R., Goddard, M. A., Hicks, D. M.et al. (2015): Where is the UK’s pollinator biodiversity? The importance of urban areas for flower visiting insects. Proc. R. Soc. B 282: 20142849. dx.doi.org/10.1098/rspb.2014.2849
Böll, S. (2017): 7 Jahre „Stadtgrün 2021“ – Einfluss des regionalen Klimas auf das Baumwachstum an drei bayerischen Standorten. Jahrbuch der Baumpflege 2017, 91-114.
Buchholz, S., Tietze, H., Kowarik, I., Schirmel, J.(2015): Effects of a major tree invader on urban woodland arthropods. Plos One 10, 1-15.
Collier, C. G. (2006):The impact of urban areas on weather. Quarterly Journal Royal Meteorological Society 132,1-25.
Habel, J. C., Ulrich, W., Biburger, N., Seibold, S., Schmitt, T.(2019): Agricultural intensification drives butterfly decline. Insect Conserv Divers. DOI: 10.1111/icad.12343
Hall, D. M., Camilo, G. R., Tonietto, R. K. et al. (2017): The city as refuge for insect pollinators. Conserv. Biol. 31, 24-29.
Hallmann, C. A., Sorg, M., Jongejans, E.et al. (2017): More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PlosOne. DOI: org/10.1371/journal.pone.0185809
Hartley, M. K., Rogers, W. E., Siemann, E. (2010):Comparison of arthropod assemblages on an invasive and native trees: abundance, diversity and damage. Arthropod-Plant Interactions 4, 237-245.
Honomichl, K., (1998):Jacobs/ Renner Biologie und Ökologien der Insekten. Gustav Fischer Verlag, Stuttgart.
Jactel, H., Brockerhoff, E. G.(2007): Tree diversity reduces herbivory by forest insects. Ecology Letters 10, 835-848.
Kehr, R., Rust, S.(2007): Auswirkungen der Klima-Erwärmung auf die Baumphysiologie und das Auftreten von Krankheiten und Schädlingen. ProBaum 4, 2-10.
Mühlenberg, M. (1993):Freilandökologie, Ulmer Verlag, Stuttgart, 3. Auflage.
Mühlethaler R., Holzinger, W., Nickel, H., Wachmann, E. (2018):Die Zikaden Deutschlands, Österreichs und der Schweiz. Quelle & Meyer Verlag, Wiebelsheim.
Nickel, H. (2008): Tracking the elusive: leafhoppers and planthoppers (Insecta: Hemiptera) in tree canopies of European deciduous forests. In:Floren, A.,Schmidl, J. (eds): Canopy arthropod research in Europe, pp. 175-214, Bioform Entomology, Nürnberg.
–(2017): Taxonomische Bestimmung heimischer und südosteuropäischer Straßenbäume im Gewerbegebiet Ost in Würzburg. Unveröff. Bericht.
–, Callot, H., Knop E., Kunz, G., Schrameyer, K., Sprick, P., Turrini-Biedermann, T., Walter, S.(2013):Penestragania apicalis (Osborn & Ball, 1898), another invasive Nearctic leafhopper found in Europe (Hemiptera: Cicadellidae, Iassinae). Cicadina 13, 5-15.
Olthoff, T. (1995):Untersuchungen zur Insektenfauna Hamburger Straßenbäume (Quercus robur L.,Tilia x europaea L.) unter besonderer Berücksichtigung standortabhängiger urbaner Beeinflussung. Unveröff. Dissertation der Universität Hamburg.
Proches, S., Wilson, J. R. U., Richardson, D. M., Chown, S. L.(2008). Herbivores, but not other insects, are scarce on alien plants. Austral Ecology 33, 691-700.
Rauh J., Paeth, H.(2011): Anthropogener Klimawandel und Weinwirtschaft – Wahrnehmung und Anpassungsmaßnahmen fränkischer Winzer auf den Wandel klimatischer Bedingungen. Bericht zur deutschen Landeskunde, Bd.85, 151-177.
Roloff, A., Gillner, S., Bonn, S. (2008): Gehölzartenwahl im urbanen Raum unter dem Aspekt des Klimawandels. Sonderheft Grün ist Leben, 30-42.
Sanchez-Bayo, F., Wyckhuys, K. A. G. (2019):Worldwide decline of the entomofauna: A review of its drivers. Biol. Conserv. 232, 8-27.
Sattler, T., Obrist, M. K., Duelli, P., Moretti, M.(2011): Urban arthropod communities: added value or just a blend of surrounding biodiversity? Landscape Urban Plan. 103 (3), 347-361.
Scheuchl, E., Willner, W. (2016): Taschenlexikon der Wildbienen Mitteleuropas. Quelle & Meyer Verlag, Wiebelsheim.
Schmolke F., Bräu M., Schnitzer K. (2006):Interessante Wanzenfunde aus Bayern unter besonderer Berücksichtigung der Coreoidea. Beiträge zur bayerischen Entomofaunistik 8, 131-181.
Schuch, S., Meyer, S., Bock, J., van Klink, R., Wesche, K. (2019):Drastische Biomasseverluste bei Zikaden verschiedener Grasländer in Deutschland innerhalb von sechs Jahrzehnten. Natur und Landschaft 94, 141-145.
Wachmann E., Melber A., Deckert J. (2004):Wanzen, Band 2. Die Tierwelt Deutschlands, 75. Teil. Goecke und Evers, Keltern
–, Melber A., Deckert J.(2007): Wanzen, Band 3. Die Tierwelt Deutschlands, 78. Teil. Goecke und Evers, Keltern
–, Melber A., Deckert J.(2008): Wanzen, Band 4. Die Tierwelt Deutschlands, 81. Teil. Goecke und Evers, Keltern
–, Melber A., Deckert J.(2006): Wanzen, Band 1. Die Tierwelt Deutschlands, 77. Teil. Goecke und Evers, Keltern
–, Melber A., Deckert J.(2012): Wanzen, Band 5. Die Tierwelt Deutschlands, 82. Teil. Goecke und Evers, Keltern
Westrich, P. (2018): Die Wildbienen Deutschlands. Ulmer Verlag, Stuttgart.
Wiesbauer, H. (2017): Wilde Bienen. Biologie – Lebensraumdynamik –Artenportraits. Ulmer Verlag, Stuttgart.
Willner, W. (2013): Taschenlexikon der Käfer Mitteleuropas. Quelle & Meyer Verlag, Wiebelsheim.
Witt, R. (1998): Wespen. Naturbuch Verlag, Augsburg.
Fazit für die Praxis
- Straßenbäume weisen hohen Individuen- und Artenreichtum ihrer Baumkronenfauna auf.
- Südosteuropäische Baumarten tragen ebenso wie ihre nah verwandten heimischen Schwesternarten zur urbanen Artenvielfalt in Baumkronen bei.
- Gemischte Alleen beherbergen eine höhere Arthropodenvielfalt als Monoalleen und wirken der Ausbreitung von zunehmend häufiger auftretenden neuen Pflanzenkrankheiten und Schädlingen entgegen.
- Verbindende Grünstreifen (statt einzelner Baumgruben) dienen als wichtiger Teillebensraum vieler baumlebender Insekten.
Kontakt
Dr. Susanne Böll ist seit 1998 an der Bayerischen Landesanstalt für Weinbau und Gartenbau beschäftigt und seit 2009 Projektleiterin des Forschungsprojekts „Stadtgrün 2021“. Studium der Biologie an den Universitäten Göttingen, Chapel Hill, North Carolina, USA, und Würzburg, dort Promotion auf dem Gebiet der Stressökologie und -physiologie im Rahmen des Sonderforschungsbereichs „Ökologie, Physiologie und Biochemie pflanzlicher und tierischer Leistung unter Stress“.
Dr. Dieter Mahsberg war bis zu seiner Pensionierung als wissenschaftlicher Mitarbeiter am Lehrstuhl für Tierökologie und Tropenbiologie (Zoologie III) am Biozentrum der Universität Würzburg tätig. Nach dem Studium der Biologie und Chemie für das Gymnasiallehramt Promotion zur Verhaltensökologie von Skorpionen. Forschungsschwerpunkte: Ökologie und Verhalten tropischer Arthropoden. Stadtökologie.
> mahsberg@biozentrum.uni-wuerzburg.de
Rosa Albrecht ist seit 2019 am Institut für Biodiversitätsinformation e.V. in Ebern tätig und betreut zurzeit das Citizen-Science-Projekt „Hummeltelefon“ (Kooperation mit BUND Naturschutz in Bayern). 2010–2018 Biologie-Studium in Würzburg. Bachelorarbeit über morphologische Merkmale und Kältetoleranz von Schwebfliegen, Masterarbeit im Rahmen von „Stadtgrün 2021“ (LWG, Veitshöchheim) über Arthropodengemeinschaften von Stadtbäumen.
PD Dr. Marcell K. Peters , Biozentrum der Universität Würzburg, Lehrstuhl für Tierökologie und Tropenbiologie (Zool. III)
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen















Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.