Die FFH-Art Alpenbock (Rosalia alpina Linnaeus, 1758) (Coleoptera, Cerambycidae) in Bayern
Abstracts
Der Alpenbock (Rosalia alpina) ist eine der wenigen prioritären Käferarten, die in Anhang II der Fauna-Flora-Habitat-Richtlinie gelistet sind. Rezente Nachweise dieser Art aus der Bundesrepublik Deutschland sind nur aus Baden-Württemberg und Bayern bekannt. Dabei kommt Bayern aufgrund der überwiegenden Zahl der Vorkommen in diesem Bundesland eine besondere Verantwortung zu.
Der vorliegende Beitrag stellt Informationen zu Datenlage und Nachweismethoden sowie zur Evaluation der Populationsgrößen, Lebensraumqualität und möglichen Beeinträchtigungen zusammen. Nachweise des Alpenbocks in den Bayerischen Alpen reichen vom Allgäu bis ins Berchtesgadenener Land und sind in nordsüdlicher Ausdehnung entlang eines relativ schmalen Bandes innerhalb der kalkführenden Formationen der Ostalpinen Zone beschränkt.
Bevorzugte Waldformation ist der Blaugras-Buchenwald (Seslerio-Fagetum). Neben der Buche (Fagus sylvatica) werden Bergahorn (Acer pseudoplatanus), Winterlinde (Tilia cordata), Bergahorn (Ulmus glabra) und Mehlbeere (Sorbus aria) als Brutbäume besiedelt. Als Habitat- und Brutsubstrat-Präferenzen werden besonnte, trockene Standorte mit trockenem, bevorzugt stehendem Totholz herausgearbeitet. Weiterhin bewertet der Beitrag den Erhaltungszustand der Art in Bayern und formuliert geeignete Maßnahmen zu Erhalt und Verbesserung der Populationen.
The Rosalia longicorn beetle (Rosalia alpina LINNAEUS, 1758) (Coleoptera, Cerambycidae) as a species under the Habitats Directive – Faunistics, ecology and conservation status in Bavaria
Recent records of the Rosalia longicorn beetle (Rosalia alpina) in Germany are only known from Baden-Württemberg and Bavaria. Bavaria has a special responsibility for the preservation of this species listed in Annex II of the Habitats Directive, due to the predominant number of German records in the federal state. This contribution compiles information on records, methods of mapping, and the evaluation of population size, habitat quality and possible impairments in Bavaria. Records of R. alpina in the Bavarian Alps range in a west-east expansion of about 210 kilometers from the Allgäu region to the Berchtesgadener Land. In north-south expansion, the occurrence is limited to a rather narrow band within the calciferous geological formations in the Eastern Alpine region. The core areas are located in calcareous beech forests (Seslerio-Fagetum). In Bavaria, the Rosalia longicorn predominantly breeds in the European beech (Fagus sylvatica), but also in sycamore maple (Acer pseudoplatanus), small-leaved lime (Tilia cordata), witch elm (Ulmus glabra), and whitebeam (Sorbus aria). There is a significant preference for sun-exposed, dry-standing deadwood both as habitats and as breeding substrate, but in open stands also lying deadwood in dry decomposition can be settled successfully. The study evaluates the conservation status of the populations of the Rosalia longicorn in Bavaria, and it outlines protection measures.
- Veröffentlicht am
1 Einleitung
Der Alpenbock (Rosalia alpina) ist eine der wenigen prioritären Käferarten in Anhang II der Fauna-Flora-Habitat-Richtlinie (Der Rat der Europäischen Gemeinschaft 1992). Rezente Nachweise der Art aus der Bundesrepublik Deutschland sind nur aus Baden-Württemberg und Bayern bekannt. Bayern hat innerhalb Deutschlands für die Erhaltung der Art eine besondere Verantwortung, da sich die meisten aktuellen Vorkommen hier befinden (Bense et al. 2003).
Zur Bewertung des Erhaltungszustands der Schutzgüter und um, sofern notwendig, geeignete Erhaltungsmaßnahmen festlegen zu können, werden in den bayerischen FFH-Gebieten Fachkartierungen durchgeführt, sie bilden die Grundlage für die Managementpläne der Gebiete. Für die Ersterfassung der Art wurde als Kartiermethode zunächst die Einrichtung von exponierten Holzpoltern erwogen, an denen sowohl Sichtbeobachtungen wie auch später Schlupflochzählung möglich gewesen wären. Dieses Vorgehen wurde jedoch verworfen, da nur eine Aussage über Präsenz und Absenz des Alpenbocks und die Entwicklung an einer künstlichen Brutstätte möglich gewesen wäre. Informationen über seine natürlichen Habitate, ihre Ausstattung, Vernetzung oder Isolation und mögliche Gefährdungen und Beeinträchtigungen wären nicht abzuleiten gewesen.
Der entscheidende Hinweis zu einer verbesserten Erfassung des Alpenbocks und seiner Habitate erfolgte durch Bense (mdl. 2000). Ehemalige und aktuelle Vorkommen lassen sich sicher über das Vorhandensein der charakteristischen Ausschlupflöcher belegen. Während der ersten Monate nach dem Schlüpfen lassen sich anhand der hellen Innenholzfärbung die diesjährigen Schlupflöcher von älteren unterscheiden (Bense 2001). Deshalb wurde eine Kartieranleitung konzipiert, die basierend auf Schlupfnachweisen in Probeflächen die Population, das Habitat und mögliche Beeinträchtigungen der Art erfasst und bewertet. Diese wurde erstmals im Jahr 2004 im Mangfallgebirge erprobt und ab 2006 als Standardmethode bei der Kartierung von FFH-Gebieten in Bayern angewandt (Binner & Bussler 2006, Bussler & Binner 2006). In Spanien (Castro et al. 2012) und Italien (Russo et al. 2010) wird bei der Kartierung der Art meist eine Kombination aus Schlupflochnachweisen und direkten Sichtbeobachtungen angewandt.
2 Nachweise und Verbreitung in Bayern
Zur Erhebung der historischen und rezenten Funddaten wurde eine umfangreiche Literaturrecherche, die Auswertung der Datenbank Artenschutzkartierung (ASK) des Bayerischen Landesamts für Umwelt, eine Befragung von Entomologen und Biologen sowie die Auswertung verschiedener Sammlungen vorgenommen. Im Jahr 2000 erfolgte eine erste Geländekartierung in Oberbayern (Bussler & Schmidl 2000). Durch die Bayerische Landesanstalt für Wald und Forstwirtschaft wurde 2001 eine Befragung der oberbayerischen Forstämter und der Nationalparkverwaltung Berchtesgaden zum Vorkommen der Art durchgeführt. 2003 erfolgten Kartierungen in den Allgäuer Alpen (Schmidl 2003) und im Nationalpark Berchtesgaden (Bussler 2004). Von 2009 bis 2015 wurden die Vorkommen in sieben FFH-Gebieten erfasst und bewertet.
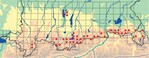
Vor dem Jahr 2000 sind Nachweise von 20 Messtischblättern und 24 Quadranten dokumentiert (Abb. 1), wobei die Funde der importierten Stücke aus der Umgebung München nicht mitgezählt wurden. In der Umgebung München waren im 19. Jahrhundert „nur wenige Einzelstücke als Flüchtlinge aus dem Gebirge“ bekannt (Horion 1974), wie die Funde bei Schäftlarn gehen sie mit Sicherheit auf Verschleppung mit Brennholz zurück. Die alten Meldungen beruhen insgesamt ausschließlich auf Funden und Beobachtungen von Einzelindividuen. Die Vorkommen bei Hinterschönau und im Hintersteiner Tal wurden erst 2003 und 2004 bei der gezielten Suche nach Ausschlupflöchern nachgewiesen, ihre Entstehung liegt jedoch vor dem Jahr 2000.
Die historischen Nachweise stammten meist von Buchenholzklaftern entlang von öffentlichen Straßen und Wegen und nicht aus den ursprünglichen Habitaten der Art. Bezeichnend sind die Beschreibungen älterer bayerischer Entomologen über die Vorkommen des Alpenbocks beim Bau des Sylvenstein-Speichers und dem Ausbau der Sylvenstein-Straße in den 50er-Jahren des 20. Jahrhunderts. Hierbei waren großflächige Rodungen von Buchenbeständen erfolgt. Das Holz wurde über Jahre besonnt an den Baustellen gelagert. Von Jahr zu Jahr waren an diesen Holzpoltern immer größere Mengen von Alpenböcken anzutreffen, bis das Holz schließlich abgefahren wurde (Witzgall mdl. 1990). Die zahlreichen Belege in der Sammlung Hirgstetter aus den Chiemgauer Alpen von 1970 bis 1979 stammen überwiegend von Rotbuchen, die bei der damals praktizierten „chemischer Läuterung“ durch das hochgiftige Pestizid Tormona 80 (2,4,5-Trichlorphenoxyessigsäure) zum Absterben gebracht worden waren.
Aktuelle Nachweise liegen ab dem Jahr 2000 von 27 Messtischblättern und von 41 Quadranten vor (Abb. 1), von weiteren elf Quadranten fehlen zurzeit rezente Nachweise, sie sind überwiegend auf Kartierlücken zurückzuführen. Der deutliche Zuwachs von Nachweisen ab dem Jahr 2000 lässt sich zurückführen auf die gezielte Kartierung der charakteristischen Schlupflöcher an potenziellen Brutbäumen, gegenüber der Imaginalerfassung, größerer Aufmerksamkeit und vermehrten Meldungen nach der Ausweisung als prioritäre Art der Fauna-Flora-Habitat-Richtlinie sowie auf die gezielte systematische Suche im ursprünglichen Habitat, auch fernab von öffentlichen Wegen.
Nachweise des Alpenbocks in Deutschland erstrecken sich in einer West-Ost-Ausdehnung von ca. 210km vom Allgäu bis ins Berchtesgadener Land. Die Vorkommen in den Alpen sind in ihrer Nord-Süd-Ausdehnung auf ein relativ schmales Band innerhalb der kalkführenden Formationen der Ostalpinen Zone beschränkt. Die oberbayerischen Vorkommen in den Alpen liegen in den FFH-Gebieten Mangfall-, Ammer- und Estergebirge, Karwendel mit Isar, Kesselberggebiet, Jachenau und Extensivwiesen bei Fleck, Östliche Chiemgauer Alpen, Geigelstein mit Achental-Durchbruch und Untersberg. Sie bilden das Nordareal der alpinen Alpenbockverbreitung, großräumige Zusammenhänge bestehen mit den Vorkommen in Österreich (Geiser 2001), die ebenfalls auf die kalkführenden Formationen der Ostalpinen Zone beschränkt sind.
Befragungen von Gebietskennern und Kartierungen im FFH-Gebiet „Nationalpark Berchtesgaden“ ergaben, dass keine rezente Alpenbockpopulation im Nationalpark existiert. Nur randlich, im Bereich des Schapbachtals, konnte ein erloschenes Vorkommen bestätigt werden. Die Ursache hierfür ist in der Baumarten- und Bestandszusammensetzung des Nationalparks begründet. Die Wälder des Nationalparks Berchtesgaden sind von der historischen Salinenwirtschaft mit ihrem immensen Holzverbrauch geprägt. Vor allem in den zugänglichen unteren Lagen des Nationalparks, in denen natürlicherweise laubholzreiche Mischwälder und Bergmischwälder aus Buche, Tanne und Fichte mit einzelnen Bergahornen stocken sollten, ist der Fichtenanteil mit 73 % besonders hoch. Die große Abweichung von der natürlichen Baumartenzusammensetzung ist der Hauptgrund für die Einrichtung eines Waldpflegebereichs in diesen Teil des Nationalparks (Konnert 2002). Die vom Alpenbock bevorzugten Baumarten Bergahorn und Rotbuche sind in der Kernzone mit 14 % und in der Waldpflegezone mit nur 7 % an der Bestockung beteiligt.
Abzüglich nicht nutzbarer Jungwüchse reduziert sich der Anteil beider Baumarten auf nur 3,8 % potenziell besiedelbarer Dimensionen (Bussler 2004).
Nachweise des Alpenbocks in den Allgäuer Alpen sind in der Faunistik der mitteleuropäischen Käfer nicht dokumentiert (Horion 1974). Der erste Nachweis der Art für die Allgäuer Alpen gelang 1997 im Bereich des Oberjochs bei Hindelang (Bussler & Schmidl 2000). Der Nachweis stammt aus dem Bereich der Klinikanlagen des Oberjocher Oberdorfes. Der Sichtnachweis konnte durch Auffinden von drei alten Ausbohrlöchern in einer abgestorbenen Buche bestätigt werden (Schmidl 2003). Aus dem FFH-Gebiet „Allgäuer Hochalpen“ lag bisher nur ein Nachweis des Alpenbocks vor. In den alten Bergahorn-Beständen auf der die Schwarzenberghütte umgebenden Almwiesen konnte 2003 in einem anbrüchigen Ahorn ein alter Fraßgang mit Ausbohrloch nachgewiesen werden, dessen Alter jedoch auf bis zu 20 Jahre geschätzt wurde. Die Kontrolle weiterer anbrüchiger Ahorne, darunter mehrere starke Hochstümpfe, und abgestorbener Buchen im umgebenden Fichten-Buchenbestand waren ohne Spuren des Alpenbocks.
Bei dem Standort handelt es sich um ein möglicherweise erloschenes Alpenbockvorkommen (Schmidl 2003). 2013 konnten Bohrlöcher in drei weiteren Bergahornen bestätigt werden, jedoch ebenfalls keine aktuellen Schlupflöcher. Die Ahorne auf der Alm sind entweder vital, ohne geeignete Totholzstrukturen, oder durch die Zersetzung von Pilzen vollständig hohl. Das dünne verbliebene Splintholz dieser Bäume ist für eine Larvenentwicklung nicht ausreichend.
Das Vorkommen des Alpenbocks auf der Alm der Schwarzenberghütte ist offensichtlich erloschen, jedoch besteht hier Potenzial für eine Wiederbesiedlung. Ein weiterer Sichtnachweis eines Exemplars erfolgte im FFH-Gebiet im Sommer 2007 am Giebelhaus im Hintersteiner Tal. 2013 konnten im Retterschwanger Tal bei Mitterhaus in einem lichten Bergulmen-Bergahorn-Steinschuttwald mit vielen abgestorbenen Bergulmen alte Bohrlöcher in zwei Ulmen nachgewiesen werden. Der Alpenbock befindet sich in den Allgäuer Alpen, im Gegensatz zu den östlich liegenden Alpenbockvorkommen in den oberbayerischen Alpen, unter der Nachweisgrenze für eine systematische Erfassung.
Eine Besonderheit sind die Nachweise aus dem Bereich (östlich) des Ammersees. Sie liegen im Bereich der Jungmoräne mit Hochterrassenschottern. Es ist das erste Vorkommen außerhalb der alpinen Region in der kontinentalen Region Bayerns. Es handelt sich um ein isoliertes Vorkommen, weitab der bisher bekannten Verbreitung der Art in Bayern. Die Habitatstrukturen im Gebiet weichen sowohl von den alpinen Vorkommen in Bayern wie auch von den Vorkommen in Württemberg auf der Schwäbischen Alb ab. Ungewöhnlich ist, dass sich das Kernhabitat der Population in einem kleinen, eng begrenzten, lichten Bereich an der Hangkante der Leitenwälder etablieren konnte, in dem die Brutbäume nur im Kronenstratum und in Lücken besiedelt werden können. Die meisten Laubwaldbestände im FFH-Gebiet sind großflächig mehrschichtig und dicht geschlossen und für den Alpenbock als Habitat ungeeignet. Einzelnachweise im Gebiet erfolgten in den Jahren 1978 und 1990, regelmäßige Beobachtungen, auch von mehreren Individuen, erst seit dem Jahr 2003.
Der Ursprung der völlig isolierten Population ist ungeklärt. Unter Umständen geht sie auf eine Verschleppung mit Brennholz zurück. In der Literatur existieren mehrere Hinweise auf Alpenbockpopulationen mit kurzfristiger Etablierung, die auf Verschleppung zurückgehen; alle diese Vorkommen sind inzwischen aber wieder erloschen (Horion 1974). Tatsache ist, dass dort eine Alpenbockpopulation in einem kleinen, eng begrenzten und isolierten Bereich seit mindestens zehn Jahren etabliert ist. Das Kernhabitat liegt in der Steilstufe kleinparzellierter, schmaler Privatwaldflächen. Die Steilstufe ist schwer begehbar und wird offensichtlich von den Waldbesitzern seit längerer Zeit nicht mehr bewirtschaftet. Am Standort kommt es in Trockenphasen zu erhöhter Mortalität der Bestockung. Deshalb findet sich hier ein hoher Anteil an stehendem Buchentotholz, vereinzelt auch an toten Ulmen.
3 Standorte und Waldgesellschaften
Rosalia alpina besiedelt in Bayern ursprünglich die kalkführenden Formationen der Ostalpinen Zone. Die meisten Nachweise stammen aus süd- und westexponierten Mittelhanglagen, aus Bachtälern und Schuttreißen. Die Standorte sind als sonnenexponiert und bodentrocken zu charakterisieren. Entscheidend für eine Besiedlung ist jedoch nicht der geologische Untergrund, sondern neben dem Brutsubstrat-Angebot ein gewisses Lichtangebot der Habitate. Die Kombination klimatischer Faktoren (Temperatur, Föhneinfluss, Niederschlag) mit Erosionsgeschehen und der Wasserspeicherkapazität der Böden bestimmen den Schlussgrad der Waldgesellschaften. Lichte Bestände finden sich natürlicherweise auf Kalkstandorten wesentlich häufiger und großflächiger als auf Urgesteinsböden oder Moränen- und Flyschstandorten.
Die Hauptvorkommen des Alpenbocks liegen im Blaugras-Buchenwald der Bayerischen Kalkalpen (Seslerio-Fagetum), der montanen Höhenform des Orchideen-Buchenwaldes (Carici-Fagetum), dem wichtigsten Lebensraum des Alpenbocks in Württemberg, und im Verband der Linden-Mischwälder (Tilio-Acerion). Im Estergebirge wurde auch ein Vorkommen in einem Mehlbeeren-Bergahorn-Mischwald (Sorbo ariae-Aceretum) auf kalkreichem Hangschutt nachgewiesen, im Allgäu in einem Bergulmen-Bergahorn-Steinschuttwald (Ulmo glabrae-Aceretum pseudoplatani). Künstlich durch Nutzung (Forstwirtschaft, Waldweide) oder natürliche Störungen (Lawinenabgänge, Steinschüttungen, Wind- oder Schneebruch) verlichtete andere Waldgesellschaften mit bedeutenden Anteilen von Rotbuche und Bergahorn werden jedoch ebenfalls besiedelt (Abb. 2, 3).
Im Blaugras-Buchenwald ist die Bestandsstruktur der Waldbestände von Natur aus licht. Rotbuche und Fichte sind die Hauptbaumarten, Nebenbaumarten sind Mehlbeere, Bergahorn und Weißtanne, örtlich auch Eibe (Walentowski et al. 2004). In der Strauch- und Krautschicht sind als Kennarten häufig Berberitze und Ästige Graslilie vertreten. Schlupflochnachweise erfolgten in Höhen von 542 m am Ammersee bis 1360 m im Mangfallgebirge. Die Art gilt als hochmobil, Flugdistanzen bis zu 1,6 km sind die Regel (Drag et al. 2011). Durch Thermik verdriftete Exemplare wurden an der Soiernhütte im Vorkarwendel in 1610m Höhe und an der Klammspitze im Ammergebirge in 1920 m gefunden. Nach Michalcewicz & Ciach 2015 werden Populationen in einem Abstand von 1500 m als gut vernetzt betrachtet, zwischen 1500 und 3000 m ist ein Austausch noch möglich, über 3 km Abstand sind die Populationen isoliert.
4 Baumarten, Brutsubstrat und Phänologie
Als bevorzugter Brutbaum des Alpenbocks in Mitteleuropa galt lange Zeit die Rotbuche, der Bergahorn als Brutbaum war nur durch einen einzigen Nachweis aus den Bayerischen Alpen bekannt (Horion 1974). Aus Südeuropa wurden Vorkommen auch von Hainbuche, Walnuss, Esche, Linden, Esskastanie und Eichen gemeldet (Bense 1995, Demelt 1966, Horion 1974). Inzwischen gelangen auch in Mitteleuropa Nachweise an Berg-, Feld- und Spitzahorn, Winterlinde, Bergulme, Esche, Hainbuche und Mehlbeere (Bussler & Schmidl 2000, Schmidl 2003, Bussler 2004, Bense et al. 2003, Bense mdl. 2015, Cizek et al. 2009, Michalcewicz et al. 2011 und 2012). Es hat sich gezeigt, dass die Art hinsichtlich ihrer Baumartenwahl sehr flexibel ist, sofern die Standort- und Substratansprüche erfüllt sind.
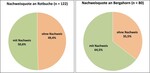
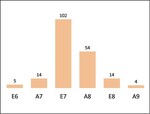
In den bayerischen FFH-Gebieten wurden bisher 380 für die Besiedlung der Art geeignete Strukturen untersucht (Tab. 1). Dies sind besonnt stehendes oder liegendes Laubtotholz und Habitatbäume mit Schadstellen in trockener Zersetzung. Schlupflochnachweise erfolgten in 210 Bäumen oder Baumteilen, davon 122 an Rotbuche, 80 an Bergahorn, sechs an Bergulme, einer an Winterlinde und einer an Mehlbeere. Während am Bergahorn an 64,5 % der untersuchten Strukturen Nachweise erfolgten, gelangen Nachweise an der Rotbuche, die in den Alpen sechsfach häufiger ist, nur an der Hälfte der Strukturen (Abb. 4).
Erfasst wurden in den FFH-Gebieten bisher 1116 Schlupflöcher an 80 Bergahornen und 907 Schlupflöcher an 122 Rotbuchen. Die durchschnittliche Anzahl pro Baumart reicht beim Bergahorn von 2,3 bis 29,6 und von 2,5 bis 11,8 bei der Rotbuche. Insgesamt wurden am Bergahorn mit 14,0 Schlupflöchern, gegenüber 7,5 Schlupflöchern an Rotbuche, fast doppelt so viele Schlupflöcher nachgewiesen (Tab. 1). Die bisher maximal festgestellte Schlupflochzahl an Einzelobjekten in den FFH-Gebieten liegt bei 87 an Bergahorn im Ester- und Ammergebirge und bei 100 an einer Rotbuche im Karwendel. Mit über 250 Ausschlupflöchern wurde die absolut höchste Anzahl, außerhalb von FFH-Gebieten, nordwestlich von Ettenhausen an einer anbrüchigen, freistehenden Hutebuche mit einem Brusthöhendurchmesser von 1,9m nachgewiesen (Abb. 5). Die festgestellten Totholzwerte in fünf FFH-Gebieten schwankten zwischen 1,6 und 6,2 fm/ha in den Probeflächen (Tab. 1). Zu berücksichtigen ist, dass es sich hierbei nur um für den Alpenbock geeignetes Totholz handelt und nicht um das gesamte Totholzangebot in den Gebieten.
Rosalia alpina benötigt zur Eiablage und Entwicklung sonnständiges Totholz in trockener Zersetzung. Das Brutmaterial wird erst belegt, wenn sich im Holz Trockenrisse gebildet haben. Sind diese Kriterien erfüllt, so werden stehende Dürrlinge, abgestorbene Partien an lebenden Bäumen und Lagerhölzer belegt. Die Bruthölzer müssen keinesfalls starke Dimensionen aufweisen, im Kronenbereich werden auch Äste von 10cm Durchmesser besiedelt, stärkere Dimension werden jedoch bevorzugt (Castro et al. 2012). Eine Bevorzugung von stehendem gegenüber liegendem Brutsubstrat wurde mehrfach vermutet (Castro et al. 2012, Duelli & Wermelinger 2010, Vögeli 2001). Auch bei den Kartierungen in Bayern ergab sich ein Verhältnis von 77 zu 23 % zugunsten stehender Strukturen. Der Anteil der stehenden Strukturen ist wahrscheinlich noch höher, da an liegendem Totholz oftmals nicht festgestellt werden kann, ob die Besiedlung nach oder vor dem Umbrechen der Hölzer erfolgt ist. Entscheidend für eine Besiedlung sind jedoch ausreichende Besonnung, trockene Zersetzung und fehlende Konkurrenz durch bestimmte holzzersetzende Pilze. Übereinander liegende Stämme („Mikadowürfe“, Abb. 6), aufragende, bodenferne Kronenteile, Hölzer auf steinigem, trockenem Untergrund oder hoch aufgeschichtete Polter und Klafter werden ebenfalls erfolgreich als Brutsubstrat genutzt (Bußler 2004, Bense mdl. 2015). Nicht besiedelt werden erdnahe, feuchte Partien von Stöcken und Stümpfen, durch Pilze fortgeschritten zersetzte, weißfaule Hölzer und liegendes feuchtes Totholz.
Ein häufig zu beobachtender negativer Faktor für eine Besiedelung der Buche durch den Alpenbock ist das Auftreten des Zunderschwamms (Fomes fomentarius). Dieser Pilz sorgt durch die Ausbildung von lederartigen Myzellappen im Holz für einen fortschreitenden Bruch von stehend befallenen Bäumen. Ausgehend von den Bruchstellen und einer erhöhten Holzfeuchte setzt eine beschleunigte Zersetzung gegenüber ungebrochenen Baumteilen ein. Damit werden die gebrochenen Stämme für den Käfer unattraktiv. Die Entwicklung des Zunderschwamms im Holzkörper setzt ausgehend von Stammverletzungen in der Regel schon am lebenden Baum ein. Das Myzelwachstum in intakten Holzpartien wird nach Absterben durch auftretende Trockenrisse ausgelöst (Baum et al. 2003), dem Zeitpunkt, an dem auch die erste Eiablage erfolgt. Schreitet die Pilzzersetzung weiter fort, kommt es zu keiner weiteren Belegung. An Buchentotholz mit vielen Fruchtkörpern finden sich deshalb meist nur alte Schlupflöcher.
Der Zunderschwamm befällt neben anderen Laubbaumarten auch den Bergahorn (Krieglsteiner 2000, Ryvarden & Gilbertson 1993). Die Entwicklung bis zum Fruchtkörper bildenden Myzel ist am Ahorn allerdings wesentlich seltener zu beobachten. Dies wird durch die Erhebungen in den bayerischen Naturwaldreservaten bestätigt. Während inzwischen 804 Funde vom Zunderschwamm an der Buche registriert wurden, liegen nur neun Nachweise von Ahorn vor. Einer der Gründe könnte die Eigenschaft des Ahorns sein, seine Holzgefäße durch die Bildung von Pfropfen zu verschließen und damit die Ausbreitung des Pilzwachstums in den noch lebenden Bäumen besser zu verhindern (Schmidt 1994).
An vom Alpenbock zur Eiablage genutzten Stämmen ist häufig auch der Brandkrustenpilz (Kretschmaria deusta) vorhanden. Beide Arten sind an besonnte Hölzer angepasst. Vom Brandkrustenpilz ist bekannt, dass sowohl große Teile seines Myzels, seiner Fruchtkörper und der Sporen einen extrem hohen Anteil von Melanin besitzen. Die Einlagerung dieses Stoffes schützt den Pilz vor dem schädigenden UV-Anteil des Sonnenlichts. Das von der Moderfäule des Brandkrustenpilzes zersetzte Holz fühlt sich bei einer Fingerprobe viel trockener an als weißfaules Holz. Im Gegensatz zu Hölzern mit Zunderschwammbesatz können Hölzer mit dem Brandkrustenpilz somit viel länger von den Käfern genutzt werden (Abb. 7).
Für 192 Exemplaren liegen für die Jahre 2000 bis 2015 genaue Beobachtungsdaten vor. Die Flugzeit des Alpenbocks beginnt Ende Juni und dauert bis Anfang September. Die meisten Sichtungen erfolgten in der zweiten Julihälfte und in der ersten Augusthälfte (Abb. 8).
5 Assoziierte wertgebende Arten
An Bergahorn im Karwendelgebirge wurde mehrfach ein gemeinsames Vorkommen des Alpenbocks mit einer weiteren Art der FFH-Richtlinie festgestellt, dem Scharlachkäfer (Cucujus cinnaberinus Scopoli, 1763). In den Östlichen Chiemgauer Alpen und im Ammergebirge war er mit dem Bockkäfer Ropalopus ungaricus (Herbst, 1784) vergesellschaftet. Nachweise zusammen mit der Rote-Liste-Art Phloeostichus denticollis Redtenbacher, 1842 erfolgten im Naturwaldreservat Friedergries bei Garmisch. An Rotbuchen wurden gleichzeitig häufiger die Bockkäfer Acanthoderes clavipes (Schrank, 1781) und Corymbia scutellata (Fabricius, 1781) und der Kopfhornschröter (Sinodendron cylindricum Linnaeus, 1758) angetroffen.
Eine gute Zeigerart der Eignung des Substrats für eine Besiedlung durch den Alpenbock ist die Anwesenheit des Gekämmten Pochkäfers (Ptilinus pectinicornis Linnaeus, 1758), da er ebenfalls nur Hölzer in trockener Zersetzung belegt; die Schlupflöcher des Pochkäfers werden von den Alpenbockweibchen auch gezielt zur Eiablage genutzt (Abb. 9). Eine interessante Beobachtung erfolgte bei einer Fotodokumentation im Naturwaldreservat Friedergries: Mehrfach wurden hier Pseudoskorpione als „blinde Passagiere“ für einen weiteren Flugtransport an Beinen und Fühlern von Alpenböcken dokumentiert (Abb. 10).
6 Erhaltungszustand und Erhaltungsmaßnahmen
Der Erhaltungszustand der Populationen des Alpenbocks bei der Ersterfassung in Bayern (Bussler & Binner 2006) ist überwiegend als gut zu bewerten. Ein Monitoring nach BfN-Kriterien wurde bisher noch nicht begonnen. Die Defizite in einigen Gebieten sind durch historische Nutzungen bedingt, beispielsweise durch die Salinenwirtschaft in den Berchtesgadener Alpen, aber auch durch einen aktiv betriebenen, großflächigen Bestockungswandel zugunsten der Fichte vom 19. bis zur Mitte des 20. Jahrhunderts. Dieser erfolgte vor allem in den ursprünglich laubholzreichen und gut zugänglichen unteren Lagen, die Habitate in den unerschlossenen Steillagen blieben hiervon aber weitgehend unbeeinträchtigt.
Erhaltungsmaßnahmen umfassen die nachhaltige Sicherung eines ausreichenden Laubholzanteils, den Erhalt von Biotopbäumen und stehendem Laubtotholz und das Belassen von Störflächen. Wo notwendig, erfolgt auch die aktive Bereitstellung von geeignetem Totholz durch Ringeln oder Schaffung von Hochstümpfen und die Anlage von Brutholzpoltern. Zur Vermeidung von Eiablagen an besonnt gelagertem Nutzholz in der Flugzeit der Art muss das Holz entweder schattig gelagert werden oder bis Mitte Juni abgefahren sein. Kritisch zu sehen ist die inzwischen intensive Energieholznutzung durch Hackschnitzelanlagen, hierbei werden vermehrt Habitatbäume und Tothölzer verarbeitet, die ökologisch wertvoll, früher aber nicht ökonomisch verwertbar waren. Indikator dafür ist, dass sich der Energieholzpreis in den letzten zehn Jahren fast verdoppelt hat.
Literatur
Baum, S., Sieber, T.N., Schwarze, F.W.M.R., Fink, S. (2003): Latent infections of Fomes fomentarius in the xylem of European beech (Fagus sylvatica). Mycological Progress 2 (2), 141-148.
Castro, A., Martinez de Murguia, L., Fernandez, J., Casis, A., Molino-Olmedo, F. (2012): Size and quality of wood used by Rosalia alpina (Linnaeus, 1758) (Coleoptera: Cerambycidae) in beech woodlands of Gipuzkoa (northern Spain). Muniba (Ciencias Naturales-Natur Zientziak) 60, 77-100.
Cizek, L., Schlaghamersky, J., Borucky, J., Hauk, D., Helesic, J. (2009): Range expansion of an endangered beetle: Alpine Longhorn Rosalia alpina (Coleoptera: Cerambycidae) spreads to the lowlands of Central Europe. Entomologica Fennica 20, 200-206.
Demelt, C. von (1966): Die Tierwelt Deutschlands 52. Teil – II Bockkäfer oder Cerambycidae. VEB Gustav Fischer, Jena, 65.
Duelli, P., Wermelinger, B. (2010): Der Alpenbock (Rosalia alpina). WSL Merkblatt für die Praxis 39 (2), 1-8.
Der Rat der Europäischen Gemeinschaft (1992): Richtlinie 92/43/EWG des Rates vom 21. März 1992 zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen. Abl. EWG L103, 22. Jg.
Drag, L., Hauck, D., Pokluda, P., Zimmermann, K., Cizek, L. (2011): Demography and Dispersal Ability of a Threatened Saproxylic Beetle: A Mark-Recapture Study of the Rosalia Longicorn (Rosalia alpina). Plos One 6 (6), 1-8.
Bense, U. (1995): Longhorn Beetles – Bockkäfer. Markgraf, Weikersheim, 250-251.
– (2001): Alpenbock (Rosalia alpina). In: Fartmann, T., Gunnemann, H., Salm, P., Schröder, E., Hrsg., Berichtspflichten in Natura-2000-Gebieten, Angew. Landschaftsökol. 42, 319-323.
–, Klausnitzer, B., Bussler, H., Schmidl, J. (2003): Rosalia alpina (Linnaeus, 1758). In: Bundesamt für Naturschutz, Hrsg., Das europäische Schutzgebietssystem Natura 2000 – Ökologie und Verbreitung von Arten der FFH-Richtlinie in Deutschland. Schr.-R. Landschaftspfl. Naturschutz 69 (1), 426-432.
Binner, V., Bussler, H. (2006): Erfassung und Bewertung von Alpenbock-Vorkommen – Umsetzung von Natura 2000 in Bayern am Beispiel von Rosalia alpina (L.,1758). Naturschutz und Landschaftsplanung 38 (12), 378-382.
Bussler, H. (2004): NATURA 2000 – FFH-Arten: Rosalia alpina (L.), Cucujus cinnaberinus (Scop.), Stephanopachys substriatus (Payk.) und Callimorpha quadripunctaria (Poda) im Nationalpark und Biosphärenreservat Berchtesgaden. Unveröff. Gutachten im Auftrag der Bayerischen Landesanstalt für Wald und Forstwirtschaft, 1-18.
–, Binner, V. (2006): Kriterien zu Bewertung des Erhaltungszustandes der Populationen des Alpenbocks Rosalia alpina (Linnaeus, 1758). In: Landesamt für Umweltschutz Sachsen-Anhalt, Hrsg., Empfehlungen für die Erfassung und Bewertung von Arten als Basis für das Monitoring nach Artikel 11 und 17 der FFH-Richtlinie in Deutschland, Ber. Landesamt f. Umweltschutz Sachsen-Anhalt, Sonderh. 2, 157-158.
–, Schmidl, J. (2000): NATURA 2000 – FFH-Arten: Untersuchungen zur Verbreitung und Ökologie von Rosalia alpina (L.) in Oberbayern. Unveröff. Gutachten im Auftrag des Bayer. Landesamtes f. Umwelt, 1-20.
Freude, H. (1951): Der Alpenbock. Jb. Verein Alpenpflanzen und tiere, München, 1-5.
Geiser, E. (2001): Die Käfer des Landes Salzburg. Monographs on Coleoptera Wien, 429.
Horion, A. (1974): Faunistik der Mitteleuropäischen Käfer. Bd. 12. Überlingen, 96-99.
Konnert, V. (2002): Waldentwicklung zwischen 1983/84 und heute. Vergleich der Waldinventuren von 1984 und 1997. In: Nationalpark Berchtesgaden, Hrsg., Forschung im Nationalpark Berchtesgaden von 1978 bis 2001, Forschungsber. 46, 21-28.
Krieglsteiner, G.J. (2000): Die Großpilze Baden-Württembergs, Bd. 1. Eugen Ulmer, Stuttgart, 629S.
Michalcewicz, J., Ciach, M. (2012): Rosalia longicorn Rosalia alpina (L.) (Coleoptera: Cerambycidae) uses roadside European ash trees Fraxinus excelsior L. – an unexpected habitat of an endangered species. Polish Journal of Entomology 81, 49-56.
–, Ciach, M. (2015): Current distribution of the Rosalia longicorn Rosalia alpina (Linnaeus, 1758) (Coleoptera: Cerambycidae) in Poland. – Polish Journal of Entomology 84, 9-20.
–, Ciach, M., Bodziarczyk, J. (2011): The unknown natural habitat of Rosalia alpina (L.) (Coleoptera: Cerambycidae) and its trophic association with the mountain elm Ulmus glabra in Poland – a change of habitat and host plant. Polish Journal of Entomology 80, 23-31.
Russo, D., Cistrone, L., Garonna, A.P. (2010): Habitat selection by the highly endangered long-horned beetle Rosalia alpina in Southern Europe: a multiple spatial scale assessment. Journal of Insect Conservation. doi 10.1007/S10841-010-9366-3.
Ryvarden, L., Gilbertson, R.L. (1993): European Polypores, Part 1. Fungiflora, Oslo, 387pp.
Schmidl, J. (2003): NATURA 2000 – FFH-Arten: Untersuchungen zum Vorkommen des Alpenbocks Rosalia alpina (L.) in den Allgäuer Alpen. Unveröff. Gutachten im Auftrag des Bayer. Landesamtes für Umwelt, 1-12.
Schmidt, O. (1994): Holz- und Baumpilze. Springer, Hamburg, 246S.
Vögeli, P. (2001): Habitatanforderungen des Alpenbocks (Rosalia alpina) in der Schweiz. Unveröff. Dipl.-Arb., Eidg. Forschungsanstalt WSL, Abt. Biodiversität, ETH Zürich, 1-87.
Walentowski, H., Ewald, J., Fischer, A., Kölling, C., Türk, W. (2004): Handbuch der natürlichen Waldgesellschaften Bayerns. Geobotanica, Freising, 441S.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen










Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.