Frühe Mahd fördert den Heilziest-Dickkopffalter im württembergischen Allgäu
Abstracts
Der Heilziest-Dickkopffalter ( Carcharodus flocciferus ) ist eine in Baden-Württemberg vom Aussterben bedrohte Tagfalterart, die auf nährstoffarme Streuwiesen angewiesen ist. Im Rahmen der Umsetzung des Artenschutzprogramms des Landes Baden-Württemberg (ASP) wurde in 16 Gebieten auf 144 experimentell bewirtschafteten Patches die Bedeutung früher Mahdzeitpunkte auf die Eiablage der Art untersucht. Früh gemähte Flächen wiesen signifikant geringere Vegetationsdichten und -höhen auf. 94 % der Eier konnten in Frühmahdbereichen gefunden werden, 71 % davon in kleinflächigen Frühmahdparzellen. Die Anzahl der Eier stieg mit geringerer Vegetationsdeckung und -höhe. Von 78 untersuchten Streuwiesen mit Heilziest-Vorkommen wurden nur 15 (19 %) als sehr gut für C. flocciferus geeignet eingestuft. Die verbliebenen Populationsgruppen sind räumlich stark isoliert und unterliegen daher einem hohen Aussterberisiko. Die Untersuchung untermauert die Bedeutung nährstoffarmer Streuwiesen mit lückiger Vegetationsstruktur. Diese Ausprägungen werden aufgrund von Nährstoffeinträgen aus angrenzenden Flächen und über die Luft immer seltener. Eine partielle frühe Mahd kann helfen, die Nährstoffgehalte der Streuwiesen zu reduzieren und gleichzeitig die von der Art zur Eiablage präferierten voll besonnten Blattrosetten des Heilziests ( Betonica officinalis ) zur Verfügung zu stellen. Langfristig sollten großzügige Pufferzonen mit extensivierter Nutzung und verringertem Düngemitteleinsatz die Nährstoffeinträge dauerhaft reduzieren.
Early mowing supports the Tufted Skipper in southwest Germany
The Tufted Skipper butterfly (Carcharodus flocciferus ) strictly depends on nutrient-poor litter meadows and is considered threatened by local extirpation in the German federal state of Baden-Württemberg. In the framework of a regional species conservation programme, we investigated the effect of early versus traditional late mowing on the species’ egg deposition in 144 experimental patches spread over 16 study sites. 94 % of all eggs were found in early mowing patches, and 71 % of these where early mowing was applied on small patches integrated into late-mown areas rich in nectar resources. Within early mowing patches, egg numbers significantly increased when vegetation density and height decreased, but were independent of the number of available Purple Betony (Betonica officinalis ) host plant shoots. Only 15 out of 78 surveyed litter meadow sites (19 %) were assigned as suitable habitat forC. flocciferus . The currently known populations are spatially fragmented and thus exposed to an elevated extinction risk. Our study confirms the importance of nutrient poor litter meadows with open vegetation structure, but these are increasingly difficult to conserve owing to direct and indirect nutrient influx. We suggest partial early mowing to buffer against nutrient accumulation and provide sun-exposed Betony shoots as preferred by egg-deposing Tufted Skippers. Long-term habitat optimization additionally requires broad buffer zones to permanently limit nutrient input.
- Veröffentlicht am

1 Einleitung
Nährstoffarme Lebensräume sind Zentren großer Artenvielfalt. Die geringen Nährstoffgehalte der Böden ermöglichen das Wachstum unterschiedlichster Pflanzenarten, die durch den Nährstoffmangel einen Konkurrenzvorteil gegenüber stickstoffliebenden Pflanzen erhalten. Diese Vielfalt an meist krautigen Pflanzenarten sowie die günstigen mikroklimatischen Verhältnisse, die in der häufig schütteren und lückigen Vegetationsmatrix nährstoffarmer Lebensräume herrschen, ermöglichen die Existenz einer artenreichen Fauna, besonders wechselwarmer Gruppen wie der Insekten.
Bis zum Beginn des 20. Jahrhunderts herrschte im landwirtschaftlich geprägten Mitteleuropa akuter Nährstoffmangel. Erst seit der Entwicklung verschiedener Düngeformen schränkt Nährstoffmangel die landwirtschaftliche Produktion nicht mehr ein. In der Folge ging der Flächenanteil nährstoffarmer Lebensräume wie Magerrasen oder streugemähter Niedermoore stark zurück, da sie durch Düngung und – im Fall der Niedermoore – Entwässerung melioriert und einer intensiveren Nutzung zugeführt wurden (Konold & Hackel1990). Die heute noch vorhandenen Reste nährstoffarmer Niedermoore sind akut durch passive Nährstoffeinträge bedroht, die über intensive Düngung angrenzender Flächen, in die Gebiete hinein entwässernde Gräben und Drainagen sowie atmosphärische Stickstoffeinträge auf die häufig in Senkenlage befindlichen Niedermoore wirken. Allein der letzte dieser Posten beträgt im Voralpenraum derzeit ca. 13 kg pro ha und Jahr (Schaapet al. 2018) und erreicht damit bereits die Untergrenze der für Streuwiesen als critical load (kritische Belastung) erachteten 15–25 kg pro ha und Jahr (AG Immissionsschutz 2012). Die Konsequenz sind dicht- und hochwüchsige Vegetationsbestände mit einer häufig hin zu stickstoffliebenden Pflanzenarten verschobenen Zusammensetzung (Quingeret al. 1995).
Der Heilziest-Dickkopffalter ( Carcharodus flocciferus ) ist eine der Arten, die auf nährstoffarme Lebensräume angewiesen sind. Aufgrund seines stetig rückläufigen Bestandes gilt er deutschlandweit als „stark gefährdet“ (Reinhardt & Bolz2011), in Baden-Württemberg als „vom Aussterben bedroht“ (Ebertet al. 2005). Seit Beginn der Aufzeichnung lepidopterologischer Daten in Baden-Württemberg wurden glaubhafte Nachweise ausschließlich südlich der Donau bekannt, weitere Funde werden auf Verwechslungen mit dem sehr ähnlichen Malven-Dickkopffalter ( Carcharodus alceae ) zurückgeführt (Albrechtet al. 1999,Ebert & Rennwald1991). Im nördlichen Oberschwaben (Umgebung Biberach a. d. Riß) wurde die Art zuletzt in den 1970er-Jahren nachgewiesen (Albrechtet al. 1999,Ebert & Rennwald1991). Im südlichen Oberschwaben sind die Vorkommen im Bodensee-Raum (z. B. Bodanrück, Deggenhausertal und Eriskircher Ried) seit den 1970er-Jahren erloschen (Albrechtet al. 1999,Ebert & Rennwald1991). Somit existiert derzeit nur noch eine kleine Populationsgruppe im württembergischen Allgäu zwischen Neukirch im Westen und Wangen im Allgäu im Osten, mit zwölf bekannten Vorkommen im Zeitraum 2000–2017 [unveröffentlichte Daten des Arten- und Biotopschutzprogramms (ASP) des Landes Baden-Württemberg].
Im Rahmen des ASP werden daher alle bekannten Vorkommen durch speziell angepasste Maßnahmen gefördert. Grundlage hierfür sind Beobachtungen im Westallgäuer Hügelland (Albrechtet al. 1999), dass bereits zur Flugzeit der Art gemähte Randbereiche von Streuwiesen mit Heilziest-Vorkommen auffallend häufig mit Eiern belegt werden. Entsprechend wird seit 2014 in 20–30 Gebieten auf wechselnden Teilflächen eine Frühmahd vorgenommen, bisher allerdings ohne stichhaltige Anhaltspunkte dafür, ob diese Maßnahme tatsächlich positive Effekte auf die Populationsentwicklung des Heilziest-Dickkopffalters hat.
In der vorliegenden Studie wurden Frühmahd-Effekte daher anhand kontrollierter Mahdversuche in acht aktuell belegten sowie acht als verwaist eingestuften Vorkommen des Falters (letzte Funde zwischen 1995 und 2001) überprüft. Untersucht wurden die Effekte von Früh- versus Spätmahd auf die Eidichten des Falters, deren Korrelation mit Vegetations- und Strukturparametern sowie der räumliche Verbund zwischen aktuell besiedelten Gebieten. Daraus werden Vorschläge für wirkungsvolle Pflegemaßnahmen in den Streuwiesen abgeleitet.
2 Material und Methoden
2.1 Autökologie des Heilziest-Dickkopffalters
Der Heilziest-Dickkopffalter (Abb. 1) besiedelt in Mitteleuropa fast ausschließlich streugemähte Niedermoore mit Vorkommen der hier einzigen Wirtspflanze, des Heilziests ( Betonica officinalis ). Meist handelt es sich um wechseltrockene Pfeifengras-Streuwiesen, die in feuchte Ausprägungen von Magerwiesen und Borstgrasrasen übergehen können (Albrecht & Kraus2013,Ebert & Rennwald1991) (Abb. 2). Gemein ist diesen Lebensräumen eine niedrigwüchsige und schüttere Vegetationsstruktur. Häufig sind Sonderstrukturen wie mineralische Kuppen, Böschungen und stark entwässerte Grabenränder in die Habitate integriert, die für eine erfolgreiche Entwicklung der Präimaginalstadien besonders günstig sind (Albrechtet al. 1999).
Die Weibchen der etwa von Ende Mai bis Mitte Juli fliegenden Falter legen ihre Eier meist einzeln an die Oberseite der Grundrosettenblätter freistehender, voll besonnter Heilziest-Pflanzen ab, bevorzugt an die Mittelrippe des Blattes (Abb. 3, vgl.Kissling & Rey2016). Die Raupen schlüpfen etwa zwei Wochen später und bauen eine sie schützende Blatttüte, die nur zur Nahrungsaufnahme verlassen wird und in der sie überwintern. Die Verpuppung erfolgt im kommenden Frühjahr im Mai. In warmen Sommern kann es zur Ausbildung einer partiellen zweiten Generation im August kommen (Albrechtet al. 1999).
2.2 Detailuntersuchungen
In jedem der 16 Untersuchungsgebiete wurden drei strukturell unterschiedliche Mahdregimes untersucht:
(i)Flächenhafte Frühmahd (auf 0,1–0,6 ha), die entsprechend den aktuellen ASP-Vorgaben zwischen dem 20. Mai und dem 10. Juni 2017 durchgeführt wurde.
(ii)Frühmahd in Kleinstparzellen (pro Gebiet drei Parzellen à 9 m² Fläche, vgl. Abb. 4), die zeitlich parallel mit der Motorsense inmitten der ansonsten spät gemähten Teilfläche ausgemäht wurden. Diese Flächen dienten dazu, neben einem Vergleich flächiger Früh- und Spätmahd auch die Bedeutung kleinflächiger Strukturheterogenität zu erfassen.
(iii) Traditionelle Spätmahd (jeweils die verbleibenden gut 2/3 der Gebiete), mit der üblichen Streuwiesenmahd ab Anfang September.
Die untersuchten Flächen umfassten unterschiedliche Ausprägungen hinsichtlich Vegetationsstruktur und -zusammensetzung sowie Exposition und Inklination, um das gesamte Spektrum vorhandener Mikrohabitate abdecken zu können. Die Eisuche und Charakterisierung der Vegetationsstruktur erfolgte in jedem der 16 Untersuchungsgebiete in jeweils neun 1-m²-Patches (jeweils drei im Spätmahdbereich, im Frühmahdbereich und in den Frühmahdparzellen). Insgesamt wurden auf diese Weise also 144 je 1¿m² große Patches angelegt (Abb. 5), für 141 davon liegen Daten vor. In jedem Patch wurden folgende Parameter aufgenommen:
- Lage (Koordinaten, Exposition),
- Anzahl der Eier pro Pflanze und Blatt,
- Lage der Eier auf dem Blatt (Blattspreite, Blattbasis, Mittelrippe),
- Deckungsgrad der Vegetation (Schätzwert in %),
- Höhe der Kraut- und Grasschicht (Messwerte in cm),
- Anzahl der Heilziest-Pflanzen.
2.3 Statistische Analyse
Die statistischen Analysen beruhen auf gemischten linearen Modellen unter Verwendung des lme4 -packages (Bates et al. 2015) für das Statistik-Paket R v.3.4.2 (R Core Team 2017). In diesen Modellen bilden „zufällige Faktoren“ die hierarchische Datenstruktur ab, in unserem Fall die drei Messungen für jedes der drei Mahdregimes innerhalb eines Untersuchungsgebietes. Dabei wurden pro Untersuchungsgebiet unterschiedliche Effekte der Mahdregimes zugelassen (sog. random slopes ). Die Überprüfung des Mahdregime-Effektes erfolgte mittels Chi²-Test über einen hierarchischen Vergleich eines Modells mit und ohne diesen Faktor. Paarweise Mittelwertvergleiche zwischen den drei Mahdregimes erfolgten unter Verwendung der ursprünglichen Modelle mittels Tukey-HSD-Posthoc-Tests im lsmeans -package (Lenth2016). Die untersuchten Vegetationsparameter folgten ausreichend den Annahmen normalverteilter Modellresiduen. Modelle mit der Anzahl gefundener Eier pro Patch als Antwortvariable wurden dagegen als Poisson-Regressionen modelliert. Letztere Analysen waren grundsätzlich auf Untersuchungsgebiete mit mindestens einem Eifund beschränkt, da nur in besiedelten Gebieten ein Effekt der Mahd auf das Eiablageverhalten feststellbar ist. Für die Analyse der Auswirkungen von Vegetationscharakteristika auf die Eizahlen sowie Korrelationen innerhalb der Vegetationscharakteristika wurden ausschließlich Patches in Frühmahd berücksichtigt, und damit solche Patches, die grundsätzlich für die Eiablage bevorzugt werden und zum Zeitpunkt der Erhebungen bereits ein Mal gemäht waren.
2.4 Räumliche Habitatkonfiguration
Die Untersuchungsgebiete wurden auf Grundlage der o. g. Parameter, ihrer Flächengröße sowie der Ausprägung und Ausdehnung potenziell geeigneter Larvalhabitate in drei Eignungskategorien (sehr gut geeignet, mäßig geeignet, ungeeignet) eingeteilt. Ebenso wurde mit 62 weiteren Flächen verfahren, die im Umkreis von 2 km um die untersuchten Habitate liegen und gemäß der §-30-Biotopkartierung Vorkommen des Heilziests aufweisen. Die gewählte Distanz können die Falter noch mit einiger Wahrscheinlichkeit überwinden (Albrechtet al. 1999).
Mit Hilfe eines geografischen Informationssystems (ArcGIS 10.5.1, ESRI Inc.) wurden Distanzen zwischen den einzelnen Gebieten errechnet. Hierdurch ließen sich einzelne Populationsgruppen sowie für eine Vernetzung notwendige Trittsteinhabitate erkennen.
3 Ergebnisse
3.1 Bewirtschaftung und Vegetationsstruktur
Erwartungsgemäß zeigten die Mahdregimes deutliche Auswirkungen auf die Vegetationsstruktur in den untersuchten Patches. Im Vergleich mit den Flächen in Frühmahd zeigten Spätmahdflächen eine dichtere Vegetationsdeckung (Abb. 6a, Mahdregime-Effekt im gemischten Modell: chi² = 36,0, df = 2, P < 0,001) sowie größere Wuchshöhen der Grasschicht (Abb. 6b, chi² = 33,3, df = 2, P < 0,001) und der Krautschicht (Abb. 6c, chi² = 23,7, df = 2, P < 0,001). Keinen signifikanten Unterschied gab es hingegen in der mittleren Anzahl Heilziest-Pflanzen pro Patch (Abb. 6d, chi² = 4,8, df = 2, P = 0,09).
3.2 Eifunde
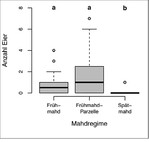
In acht der 16 (50 %) Gebiete konnten insgesamt 66 Eier nachgewiesen werden. Hiervon befanden sich 18 Eier (27 %) in Frühmahdflächen, 44 Eier (67 %) in manuell gemähten Frühmahdparzellen und vier Eier (6 %) in den Spätmahdflächen. Maximal wurden sieben Eier in einer einzigen Frühmahdparzelle und 21 Eier in einem Untersuchungsgebiet gefunden.
Innerhalb der besiedelten Gebiete hatte das Mahdregime einen signifikanten Einfluss auf die Eizahl pro Patch (Mahdregime-Effekt im gemischten Modell: chi² = 39,9, df = 2, P < 0,001, Abb. 7). Dabei wurden sowohl in den Frühmahdflächen (Post-hoc Z = –2,99, p = 0,008) als auch in den Frühmahdparzellen (Z = –4,71, p < 0,001) signifikant mehr Eier gefunden als bei Spätmahd. Frühmahdparzellen hatten im Schnitt etwas höhere Eizahlen als Frühmahdflächen (Z = 2,79, p = 0,015).
Die Eier wurden zu 41 % an der Blattbasis, zu 54,5 % entlang der Mittelrippe abseits der Blattbasis und zu 4,5 % auf der Blattspreite abgelegt. In 6,6 % der Fälle gelang der Nachweis von mehreren Eiern pro Blatt. Zweimal konnte eine Eiablage in die Blütenstände des Heilziests beobachtet werden.
3.3 Korrelationen von Eiablage und Vegetationsstruktur
Innerhalb der primär zur Eiablage genutzten Frühmahdflächen und -parzellen war die Anzahl gefundener Eier unabhängig von der Anzahl verfügbarer Heilziest-Pflanzen (gemischtes Modell: chi² = 0,14, df = 1, P = 0,71, Abb. 8d) und der Höhe der Krautschicht (chi² = 1,1, df = 1, P = 0,29, Abb. 8c), sie sank jedoch mit dem Deckungsgrad der Krautschicht (chi² = 6,7, df = 1, P = 0,0098, Abb. 8a) sowie tendenziell mit der Höhe der Grasschicht (chi² = 3,4, df = 1, P = 0,067, Abb. 8b).
Auf den früh gemähten Patches ergaben sich starke Korrelationen zwischen den verschiedenen Vegetationscharakteristika. Der Deckungsgrad der Vegetation korrelierte stark positiv mit der Höhe der Krautschicht (gemischtes Modell: chi² = 16,7, df = 1, P < 0,001, Abb. 9a) und die Anzahl der Ziest-Pflanzen schwach positiv mit der Vegetationsdeckung (chi² = 5,7, df = 1, P = 0,017, Abb. 9b). Die Anzahl der Ziest-Pflanzen korrelierte dagegen nicht mit der Höhe der Krautschickt (chi² = 1,7, df = 1, P = 0,19, Abb. 9c).
3.4 Räumliche Habitatkonfiguration
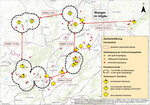
Von den 78 bewerteten Flächen (vgl. Material und Methoden) wurden 15 Flächen (19 %) als „sehr gut geeignet“, 28 Flächen (36 %) als „mäßig geeignet“ und 35 Flächen (45 %) als „ungeeignet“ eingestuft. Bei mäßig geeigneten oder ungeeigneten Flächen waren Heilziest-Bestände fast ausschließlich in dicht- und hochwüchsiger Vegetation und/oder nur vereinzelt vorhanden. Aufgrund der Habitatansprüche von C. flocciferus (Albrechtet al. 1999,Kissling & Rey2016, diese Studie) kommen nur die 15 sehr gut geeigneten Flächen als Habitate in Frage. Hierdurch ergibt sich ein deutlich aufgelöstes Habitatnetz mit einzelnen, voneinander getrennten Metapopulationsgruppen (Abb. 10). Die Abstände zwischen diesen Populationsgruppen betragen zwischen 2,5 und 3,4 km. Das Vorkommen im NSG Gießenmoos östlich von Wangen im Allgäu ist sogar 6,5 km von den nächsten bekannten baden-württembergischen Populationen entfernt.
4 Diskussion
4.1 Mikrohabitate
Für C. flocciferus konnte im Rahmen dieser Untersuchung eine deutliche Eiablagepräferenz für früh gemähte Bereiche innerhalb der traditionell spät gemähten Streuwiesen nachgewiesen werden – 94 % der Eifunde gelangen hier, bevorzugt in Bereichen mit besonders geringer Vegetationsdeckung und damit offenstehenden, voll besonnten Grundblattrosetten des Heilziests. Die stichprobenhaften Beobachtungen vorangegangener Untersuchungen (Albrechtet al. 1999,Kissling & Rey2016) von Eiablagen in früh gemähte Bereiche können wir damit auch in größerem Maßstab sowie auf Basis eines experimentellen Mahdregimes bestätigen.
Dieser Eiablagepräferenz können unterschiedliche Ursachen zugrunde liegen: Zunächst dürften die durch Mahd freigestellten Rosetten des Heilziests für Weibchen besonders gut auffind- und anfliegbar sein und damit die Eiablage erleichtern. Weiterhin könnten die voll besonnten Rosetten ein besonders günstiges Mikroklima aufweisen und eine rasche und erfolgreiche Entwicklung der Präimaginalstadien ermöglichen. Eine Bevorzugung offener, lückiger Strukturen und warmer Mikroklimate für die Eiablage und die Larvalentwicklung ist auch für zahlreiche weitere Tagfalterarten belegt (Übersicht inFartmann & Hermann2006).
Auffällig war eine Häufung von Eifunden in den kleinflächigen 9-m²-Frühmahdpatches gegenüber flächig gemähten Frühmahdbereichen. Dies deutet an, dass kleinflächig früh gemähte Bereiche innerhalb traditioneller Spätmahd für die Weibchen besonders attraktiv sind. Verhaltensbeobachtungen zeigen, dass Weibchen zwischen einzelnen Eiablagen häufig Nektar aufnehmen (Albrechtet al. 1999). Eine mosaikartige Vernetzung zwischen Nektarhabitaten in spät gemähten Streuwiesen und Eiablagehabitaten in den Frühmahdpatches deutet sich daher als optimale Verzahnung gemäß den Ansprüchen der Falter sowie ihrer Larvalstadien an (vgl.Bräu & Nunner2003 für weitere Insektenarten).
Keinen Einfluss auf die Eifunde hatte dagegen innerhalb der früh gemähten Bereiche die verfügbare Anzahl an Heilziest-Pflanzen. Möglicherweise sind die Bestände der Wirtspflanze in den hier untersuchten Gebieten grundsätzlich ausreichend groß, um den eher geringen Nahrungsbedarf der meist einzeln an einer Futterpflanze sitzenden Jungraupen zu decken (vgl.Albrechtet al. 1999,Kissling & Rey2016). Viele Tagfalterarten meiden sogar kräftige Dominanzbestände ihrer Wirtspflanze (z. B.Hermann1999). Die Einbettung der Wirtspflanze in die Vegetationsstruktur und die damit verbundenen mikroklimatischen Bedingungen sind demnach für eine erfolgreiche Entwicklung wichtiger als das Vorhandensein großer Bestände der Wirtspflanze.
4.2 Gefährdung
Unsere Daten deuten an, dass der Rückgang von C. flocciferus durch einen Mangel an geeigneten Eiablagestellen und Mikrohabitaten für die Entwicklung der Präimaginalstadien gefördert wird. Die präferierten geringen Deckungsgrade und Aufwuchshöhen von Gras- und Krautschicht sind in Folge der großflächig hohen Nährstoffeinträge inzwischen sehr selten geworden. Dies führt offenbar dazu, dass auch in den nährstoffarmen Streuwiesen die traditionell im Spätsommer durchgeführte Mahd nicht mehr ausreicht, um Wirtspflanzen in genügend lückiger Vegetationsstruktur bereitzustellen. Nur wenige besonders aufwuchs- und nährstoffarme Streuwiesen sowie kleinflächige Sonderstrukturen (Rohbodenbereiche, Böschungskanten, Grabenränder) bieten der Art noch geeignete Reproduktionsbedingungen. Diese sind im württembergischen Allgäu inzwischen in so geringer Zahl und räumlich derart isoliert vorhanden, dass eine Verknüpfung geeigneter Habitate im Sinne des Metapopulationsprinzips (Hanski1998) nicht mehr gegeben ist. Der Streuwiesenschwund auf ca. 2–5 % ihrer ursprünglichen Ausdehnung (Quingeret al. 1995,Seiffert & Konold1998) hat für die anspruchsvolle Art geeignete Habitate derart verinseln lassen, dass ein Austausch zwischen den verbliebenen fünf Vorkommens-Clustern äußerst unwahrscheinlich ist, vor allem da es sich bei C. flocciferus um einen ortstreuen K-Strategen handelt (Albrechtet al. 1999).
Es ist davon auszugehen, dass vor 1950 nährstoffarme und relativ stark entwässerte Streuwiesen der Regelfall im württembergischen Allgäu waren (Konold & Hackel1990,Quingeret al. 1995). Zudem wurden angrenzende mineralische Standorte nur extensiv bewirtschaftet, sodass für C. flocciferus besonders attraktive Habitate im fließenden Übergang von Feucht- zu Trockenstandorten existierten (Bräu & Nunner2013). Zu dieser Zeit dürfte der Heilziest-Dickkopffalter deutlich weiterverbreitet gewesen sein. Durch die in den 1950er- und 1960er-Jahren erfolgte flächige Intensivierung landwirtschaftlicher Nutzung (Entwässerung, Meliorierung, Aufdüngung vieler Niedermoor- und fast aller mineralischen Standorte, Erhöhung der Schnittzahlen) und die dadurch bedingte Eutrophierung der Streuwiesenreste änderte sich dieses Bild grundlegend. Die schwindende Bedeutung der Streuwiesenkultur und das (oft aus gutem Grunde) negative „Image“ von Entwässerungen führten außerdem dazu, dass alte Graben- und Entwässerungssysteme nicht mehr unterhalten wurden. Diese sind noch heute in vielen Niedermoorgebieten zu erkennen, erfüllen aber ihren Zweck aufgrund langjähriger Pflegedefizite nicht mehr. Viele streugenutzte Niedermoore wurden somit offenbar aufgrund von Eutrophierung und Vernässung zunehmend unattraktiver für den Heilziest-Dickkopffalter – die Ausdehnung von für die Art geeigneten Streuwiesen in Baden-Württemberg umfasst nur noch wenige Hektar.
4.3 Pflegeempfehlungen
Die größte Herausforderung für den Erhalt des Heilziest-Dickkopffalters in Baden-Württemberg ist, die Nährstoffgehalte in den Streuwiesen dauerhaft zu reduzieren, um die benötigte schwachwüchsige und lückige Vegetationsstruktur zu schaffen. Langfristig erfordert dies Anpassungen der landwirtschaftlichen EU-Förderpolitik zur Reduktion der direkt ausgebrachten bzw. über die Luft eingetragenen Düngemittel. Kurzfristig kann die Einrichtung möglichst breiter Pufferzonen mit düngungsfreier Bewirtschaftung die Nährstoffeinträge in die Streuwiesen reduzieren (Quinger2003). Gerade diese Pufferzonen, in denen meist Feucht- und Nasswiesen ausgebildet sind, sind aufgrund der geringen Fördersummen und der regionalen Wasserkreuzkraut-Problematik aktuell stark rückläufig (LEVRavensburg 2016).
Zudem sollten die im Rahmen des ASP etablierten, jahrweise wechselnden Frühmahdflächen beibehalten und auf weitere Standorte ausgeweitet werden. Sie stellen momentan die am besten geeigneten Reproduktionshabitate für C. flocciferus dar und können helfen, die Bestände an den rezenten Vorkommensorten zumindest zu stabilisieren. Um eine Ausbreitung zu ermöglichen, sollten entsprechende Frühmahdbereiche auch auf benachbarten Streuwiesen etabliert werden, die sich aktuell in keinem geeigneten Pflegezustand befinden und unbesiedelt sind. Die Frühmahd für C. flocciferus muss – im Gegensatz zur Frühmahd zur Aushagerung wüchsiger und/oder verschilfter Vegetationsbestände – auch auf augenscheinlich intakten Teilflächen von Streuwiesen stattfinden, da der Heilziest bevorzugt in diesen Bereichen wächst. Als optimaler Mahdzeitraum erscheint Ende Mai bis Anfang Juni, da dann die Heilziest-Blattrosetten bis zum Beginn der Flugzeit Mitte Juni etwas nachgetrieben haben und die Streuwiesen-Vegetation bis zum Herbst noch ausreifen kann (Bamann2017).
Ergänzend sollte eine Hochsommermahd im Juli oder August in Betracht gezogen werden, wie sie traditionell auf wechseltrockenen Streuwiesen mit Tendenz zur Heuwiese stattfand (Bräu & Nunner2003,Quingeret al. 1995). Diese dient insbesondere zur Aushagerung und sollte wie die Frühmahd nur an geeigneten Standorten und auf wechselnden Teilflächen durchgeführt werden. Für die zukünftige Umsetzung des ASP ist ein entsprechender Ansatz eingeplant.
Bei der Grabenpflege ist eine geeignete Frequenz entscheidend. Zu häufige und tiefe Grabenräumungen führen zu übermäßiger Entwässerung der Fläche und begünstigen die Torfmineralisation. Daraus resultieren eine weitere Nährstofffreisetzung sowie irreversible Strukturveränderungen des Torfbodens (Briemle1985,Quingeret al. 1995). Zu seltene Grabenräumungen führen dagegen zu übermäßiger Vernässung, die die Bewirtschaftbarkeit einschränkt und die Vegetationszusammensetzung in Richtung Klein- und Großseggenrieden verschiebt. Letzteres ist gerade in Naturschutzgebieten häufig zu beobachten, da Grabenräumungen aufgrund ihres negativen „Images“ (s. o.) in der Vergangenheit stark vernachlässigt wurden. Eine Wiederaufnahme einer abschnittsweisen und schonenden Grabenräumung würde Habitate für Arten wechseltrockener Streuwiesen schaffen und gleichzeitig die Gräben für die Besiedlung verschiedener gefährdeter Libellenarten öffnen (Bamann2017).
Maßnahmen, die rein dem Individuenschutz dienen (z. B. Verwendung von Balkenmähern, große Mahdhöhen, Abstandhalterkufen), sind aus Sicht der Autoren nicht geeignet, die Art nachhaltig zu fördern. Bei längerfristigem Einsatz können sich derartige Maßnahmen durch Verfilzung der unteren Vegetationsschicht und einem daraus resultierenden Mangel an Offenbodenstellen sogar negativ auswirken. Vielmehr sollte geprüft werden, ob durch tief gestellte Schwader oder Verwendung eines Sportplatz-Strieglers (oder ähnlicher Gerätschaften) die Bodendecke aufgelockert werden kann, um die Keimung des Heilziests zu fördern und Offenbodenstellen zu schaffen. Derartige Maßnahmen förderten in Bayern beispielsweise die Arnika ( Arnica montana ), die dem Heilziest vergleichbare Lebensraumansprüche besitzt (Blachnik & Saller2015).
Literatur
AGImmissionsschutz(2012):Leitfaden zur Ermittlung und Bewertung von Stickstoffeinträgen. Bund/Länder-Arbeitsgemeinschaft für Immissionsschutz - Fachgespräch N-Deposition. Stand 1. März 2012.
Albrecht, M. (2003):Zum ehemaligen Vorkommen des Heilziest-Dickkopffalters (Carcharodus floccifera Zeller, 1847) im Rhein-Main-Gebiet (Lepidoptera, Hesperiidae). Nachr. entomol. Ver. Apollo N.F. 24 (4), 215-220.
–, Kraus, W. (2013):Heilziest-Dickkopffalter -Carcharodus flocciferus (Zeller, 1847). In:Bräu, M., Bolz, R., Kolbeck, H., Nunner, A., Voith, J., Wolf, W.(Hrsg.): Tagfalter in Bayern. Ulmer, Stuttgart, 72-74.
–, Treiber, R., Goldschalt, M.(1999): Der Heilziest-Dickkopffalter (Carcharodus floccifera Zeller, 1847) (Lepidoptera, Hesperiidae). Morphologie, Verbreitung, Ökologie, Biologie, Verhalten, Lebenszyklus, Gefährdung und Schutz einer interessanten Tagfalterart. Nachr. entomol. Ver. Apollo N.F., Supplementum 18, 1-256.
Bamann, T.(2017): Die Tagfalter und Widderchen der Streuwiesen im württembergischen Allgäu – Arten, Verbreitung, Gefährdung und Schutz. Carolinea 75, 89-106.
Bates, D., Maechler, M., Bolker, B., Walker, S.(2015). Fitting Linear Mixed-Effects Models Using lme4. J. Stat. Software 67, 1-48.
Blachnik, T., Saller, S.(2015):Arnica montana – Revitalisierung und Nutzung als Heilpflanze im Bayerischen Vogtland und nördlichem Fichtelgebirge. Schlussbericht Bundesprogramm Biologische Vielfalt, 48 S.
Bräu, M., Nunner, A. (2003):Tierökologische Anforderungen an das Streuwiesen-Mahdmanagement mit kritischen Anmerkungen zur Effizienz der derzeitigen Pflegepraxis. Lauf. Seminarbeitr. 1/03, 223-229.
–, Nunner, A.(2013): Feuchte Offenlandlebensräume. In:Bräu, M., Bolz, R., Kolbeck, H., Nunner, A., Voith, J., Wolf, W.(Hrsg.): Tagfalter in Bayern. Ulmer, Stuttgart, 582-607.
Briemle, G.(1985): Vegetations- und Standortentwicklung auf Niedermoor unter dem Einfluss verschiedener Pflegemaßnahmen, erste Tendenzen nach fünf Versuchsjahren. Telma 15, 197-221.
Ebert, G., Rennwald, E. (Hrsg.) (1991): Die Schmetterlinge Baden-Württembergs. Band 1, Tagfalter 1. Ulmer, Stuttgart.
–, Hofmann, A., Meineke, J.-U., Steiner, A., Trusch, R. (2005): Rote Liste der Schmetterlinge (Macrolepidoptera) Baden-Württembergs (3. Fassung). In:Ebert, G. (Hrsg.): Die Schmetterlinge Baden-Württembergs. Band 10, Ergänzungsband. Ulmer, Stuttgart, 110-133.
Fartmann, T., Hermann, G.(2006): Larvalökologie von Tagfaltern und Widderchen in Mitteleuropa. Abh. Westf. Mus. Naturkde. 68 (3/4), 83-122.
Hanski, I. (1998): Metapopulation dynamics. Nature 396, 41–49.
Hely, M.(2017): Untersuchungen zum Schutz des Heilziest-Dickkopffalters (Carcharodus flocciferus , Zeller 1847) im württembergischen Allgäu – Einfluss früher Mahdzeitpunkte und Metapopulationsanalyse. Unveröff. Masterarbeit an der Eberhard-Karls-Universität Tübingen, 57 S.
Hermann, G. (1999): Methoden der qualitativen Erfassung von Tagfaltern. In:Settele, J., Feldmann, R., Reinhardt, R.(Hrsg.): Die Tagfalter Deutschlands – Ein Handbuch für Freilandökologen, Umweltplaner und Naturschützer. Ulmer, Stuttgart, 124-143.
Kissling, T., Rey, A. (2016):Artenschutzprojekt für den Heilziest-DickkopffalterCarcharodus floccifera in den östlichen Vor- und Nordalpen. Fachstellen für Natur- und Landschaftsschutz Glarus, Nidwalden, St. Gallen, 36 S.
Konold, W., Hackel, A. (1990):Beitrag zur Geschichte der Streuwiesenkultur im Alpenvorland. Z. Agrargesch. Agrarsoz. 38 (2), 176-191.
Lenth, R.V. (2016): Least-Squares Means: The R Package lsmeans. J. Stat. Software 69, 1-33.
LEVRavensburg(2016):Geschäftsbericht 2016. Landschaftserhaltungsverband Landkreis Ravensburg e. V., 29 S.
Quinger, B.(2003): Empfehlungen zur Anwendung verschiedener Mahdmanagements zur Pflege der Streuwiesen im bayerischen Alpenvorland. Lauf. Seminarbeitr. 1/03, 203-222.
–, Schwab, U., Ringler, A., Bräu, M., Strohwasser, R., Weber, J.(1995): Lebensraumtyp Streuwiesen. Landschaftspflegekonzept Bayern, Band II.9, 396 S.
R Core Team (2017): R: A language and environment for statistical computing. R Foundation for Statistical Computing. www.R-project.org/
Reinhardt, R., Bolz, R. (2011): Rote Liste und Gesamtartenliste der Tagfalter (Rhopalocera) (Lepidoptera: Papilionoidea et Hesperioidea) Deutschlands. In: Bundesamt für Naturschutz (Hrsg.): Rote Liste gefährdeter Tiere, Pflanzen und Pilze Deutschlands - Band 3: Wirbellose Tiere (Teil 1). Naturschutz und Biologische Vielfalt 70 (3), 167-194.
Schaap, M., et al. (2018): PINETI-III: Modellierung und Kartierung atmosphärischer Stoffeinträge von 2000 bis 2015 zur Bewertung der ökosystem-spezifischen Gefährdung von Biodiversität in Deutschland. Abschlussbericht an das Umweltbundesamt, URL: https://gis.uba.de/website/depo1/ (gesehen am 30.10.2018).
Seiffert, P., Konold, W.(1998): Landschaftswandel in Kißlegg (Allgäu). Naturschutz und Landschaftsplanung 30 (10), 315-323.
Fazit für die Praxis
- Artenschutzmaßnahmen imitieren oft traditionelle Bewirtschaftungsformen wie etwa die Spätmahd in Streuwiesen. Am Beispiel des Heilziest-Dickkopffalters zeigt sich, dass diese Praxis die Ansprüche wichtiger Zielarten des Naturschutzes nur teilweise abbilden kann.
- Spätmahd schafft nur unzureichende Habitatheterogenität und begünstigt aufgrund indirekter Nährstoffeinträge eine schleichende Habitatverschlechterung.
- FürC. flocciferus kann rotierende Frühmahd, bevorzugt auf kleinen Teilflächen, optimal geeignete Eiablagestandorte innerhalb reichhaltiger Nektarressourcen bereitstellen.
Kontakt
Myrielle Hely ist Geoökologin und hat im Rahmen ihrer Masterarbeit an der Universität Tübingen die hier vorgestellten Eiablagepräferenzen des Heilziest-Dickkopffalters untersucht. Derzeit tätig im Büro Emch + Berger Umwelt Karlsruhe in der Umwelt- und Landschaftsplanung.
Dr. Nils Anthes , Evolutionsbiologie und Landschaftsökologe, lehrt und forscht an der Universität Tübingen, u. a. zur visuellen Ökologie mariner Lebensräume sowie den Effekten von Landnutzung und Artenschutzmaßnahmen auf die Biodiversität insbesondere in Agrarlandschaften. Hat u. a. über die Larvalhabitate verschiedener Tagfalter im Voralpenraum gearbeitet.
> nils.anthes@uni-tuebingen.de
Dr. Thomas Bamann ist seit 2012 Mitarbeiter im Regierungspräsidium Tübingen – Referat 56 „Naturschutz und Landschaftspflege“, und dort seit 2016 Gebietsreferent für die Landkreise Ravensburg und Bodenseekreis. Seit 2013 freiberuflicher Landschaftsökologe mit faunistischem Schwerpunkt, u. a. Umsetzung des Artenschutzprogrammes Schmetterlinge des Landes Baden-Württemberg. Nach dem Studium der Biologie an der Universität Tübingen 2015 Promotion über Tagfalter der GattungErebia .
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen








Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.