In-situ-Erhaltung von Wildselleriearten
Abstracts
W ildlebende V erwandte von K ulturarten (WVK) sind eine unverzichtbare und zugleich gefährdete genetische Ressource der Pflanzenzüchtung. Am Beispiel von Wildselleriearten wird dargestellt, wie die genetischen Ressourcen von WVK in ihren natürlichen Lebensräumen (in situ) aktiv erhalten werden können. Zu diesem Zweck werden im Rahmen eines Modell- und Demonstrationsvorhabens Vorkommen identifiziert, die die genetische Diversität im Verbreitungsareal von Wildselleriearten bestmöglich repräsentieren. Für die langfristige Erhaltung dieser Vorkommen sollen genetische Erhaltungsgebiete ausgewiesen werden. Das Verfahren zur Auswahl von Vorkommen und für die Ausweisung genetischer Erhaltungsgebiete geeigneter Flächen, das räumliche Modell des genetischen Erhaltungsgebietes und die ersten praktischen Ergebnisse des Projektes werden im Beitrag dargestellt. Das Ziel des Projektes besteht im Aufbau eines bundesweiten Netzwerkes genetischer Erhaltungsgebiete für Echten Sellerie ( Apium graveolens ) , Kriechenden Sellerie ( Helosciadium repens ), Knotenblütigen Sellerie ( H. nodiflorum ) und Flutenden Sellerie ( H. inundatum ), die vier in Deutschland einheimischen Wildselleriearten.
In-situ conservation of species of wild celery – Example for genetic resources of Crop Wild Relatives (CWR)
Crop Wild Relatives (CWR) species are an indispensable and at the same time threatened genetic resource of plant breeding. The study uses wild species related to celery to demonstrate how genetic resources of CWR can actively be maintained in their natural surroundings (in situ). To this end occurrences are identified within the scope of a model and demonstration project which can best maintain the genetic diversity of wild celery species present in their distribution area. Genetic reserves should be designated for long term conservation of selected occurrences.
The paper presents the selection procedure aiming at the identification of occurrences and sites suitable for the designation of genetic reserves, the spatial model of a genetic reserve and first practical results of the project. The project aims at the establishment of a nationwide network of genetic reserves forApium graveolens ,Helosciadium repens ,H. nodiflorum andH. inundatum , the four wild celery species native to Germany.
- Veröffentlicht am

1 Einleitung
Im Rahmen der Richtlinie zur Förderung von Modell- und Demonstrationsvorhaben im Bereich der Erhaltung und innovativen, nachhaltigen Nutzung der biologischen Vielfalt fördert das Bundesministeriums für Ernährung und Landwirtschaft (BMEL) das Projekt „Genetische Erhaltungsgebiete für Wildselleriearten ( Apium und Helosciadium ) als Bestandteil eines Netzwerkes genetischer Erhaltungsgebiete in Deutschland“ (GE-Sell). Die vier Arten Echter Sellerie ( Apium graveolens L. ssp. graveolens ), Kriechender Sellerie [ Helosciadium repens (Jacq.) W. D. J. Koch (Syn. A. repens (Jacq.) Lag.)], Knotenblütiger Sellerie [ H. nodiflorum (L.) W. D. J. Koch (Syn. A. nodiflorum L.)] und Flutender Sellerie [ H. inundatum (L.) W. D. J. Koch (Syn. A. inundatum (L.) Rchb.f.)] (Abb. 1) stehen dabei stellvertretend für eine Gruppe von Wildpflanzenarten, die als wildlebende Verwandte von Kulturarten (WVK) bezeichnet wird. Die überaus große Bedeutung von WVK als pflanzengenetische Ressource für die Züchtungsforschung und Sortenzüchtung belegen zahlreiche Nachweise (z.B.Kole2011).
Ausgerechnet in einer Zeit, in der Wildpflanzenarten in der Sortenzüchtung an Bedeutung gewinnen, schreitet der Artenverlust fort (Bilzet al.2011) und verringert damit den Handlungsspielraum der Pflanzenzüchtung mit nicht absehbaren Folgen für die Kultur- und Nutzpflanzenproduktion (Wehlinget al. 2017). Bilzet al. (2011) beurteilten den Erhaltungszustand einer Auswahl europäischer WVK: Von den 572 nach IUCN-Kriterien bewerteten Arten sind 16 % unterschiedlich stark gefährdet. Bei weiteren 29 % der WVK konnte keine Bewertung vorgenommen werden, weil die Datengrundlage fehlt. In ihrer Halbzeitbewertung der EU-Biodiversitätsstrategie 2020 kommt die EU-Kommission zu dem Schluss, dass sich der Erhaltungszustand der Mehrzahl von Arten und Lebensräumen weiterhin verschlechtern wird (EU 2016). Unter dem Einfluss des Klimawandels verlieren europäische WVK geeignete Habitate im heutigen Verbreitungsgebiet, wie auf der Webseite www.cwrnl.nl/nl/CWRnl/CWRspergewas/ Apium-repens-Jacquin-Lag..htm u.a. für H. repens dargestellt (Aguirre-Guitérrezet al. 2017). Angesichts dieser Entwicklung ist es zwingend notwendig, die Erhaltung von Wildpflanzenarten in ihren natürlichen Verbreitungsarealen (in situ) zu verbessern. Diese Forderung ist nicht neu.
Nach Art. 8 a) bis d) des Übereinkommens über die biologische Vielfalt (CBD) soll jede Vertragspartei Maßnahmen zur Bewahrung lebensfähiger Populationen von Arten in ihrer natürlichen Umgebung entwickeln und umsetzen. Auch der Aufbau eines Systems von Schutzgebieten wird gefordert (CBD 1992). Völkerrechtlich bindende Vorgaben zur In-situ-Erhaltung von WVK (Art. 5, 1 a-d) enthält auch der International Treaty on Plant Genetic Resources for Food and Agriculture (FAO 2001).
Dennoch existieren bundesweit koordinierte Maßnahmen zur systematischen In-situ-Erhaltung dieser Artengruppe nicht. Mit der Verabschiedung der europäischen Konzeption zur In-situ-Erhaltung pflanzengenetischer Ressourcen (Maxtedet al. 2015) durch das Europäische Kooperationsprogramm für pflanzengenetische Ressourcen (ECPGR 2017) haben sich unterdessen die Rahmenbedingungen positiv verändert. Diese Entwicklung wurde durch die Einführung und international allgemein akzeptierte Definition des Begriffs „wildlebende Verwandte von Kulturpflanzen“ (Maxtedet al. 2006) sowie des Begriffs „genetisches Erhaltungsgebiet“ (Maxtedet al. 1997) unterstützt.
Im vorliegenden Beitrag wird erörtert, wie mit Hilfe des monographischen Lösungsansatzes, auch Genpoollösungsansatz genannt (Maxtedet al. 2011), für den Aufbau und die Ausweisung genetischer Erhaltungsgebiete geeignete Populationen und Flächen identifiziert werden können. Anhand des Modellobjektes „Wildsellerie“ werden Projektergebnisse vorgestellt so-wie der weitere Handlungsbedarf angesprochen.
2 Genetisches Erhaltungsgebiet, ein Modul des Artenschutzes
Der Artenschutz steht im Wettbewerb mit anderen Flächennutzungen, die für die Grundversorgung der Bevölkerung gleichermaßen wichtig sind. Durch die Ausweisung von Flächen für die Erhaltung von WVK wird die Bedeutung des allgemeinen Natur- und Artenschutzes für die Entwicklung einer nachhaltigen Agrarproduktion hervorgehoben und die Position des Artenschutzes im Wettbewerb um Flächen gestärkt. Aufgrund dieser Überlegungen betrachtenZehm&Weber(2013) genetische Erhaltungsgebiete als ein Modul des allgemeinen Artenschutzes.
Ein genetisches Erhaltungsgebiet ist definiert als Fläche, die für aktive und dauerhafte Erhaltungsmaßnahmen ausgewiesen wird und auf der Management und Monitoring der genetischen Vielfalt natürlich vorkommender Wildpflanzenpopulationen erfolgen (Maxtedet al. 1997). Der Zweck eines genetischen Erhaltungsgebiets ist es, die innerartliche genetische Vielfalt und die regionaltypischen Anpassungsmuster zu sichern. Für den Schutz einer repräsentativen Stichprobe der innerartlichen Vielfalt ist deshalb eine Anzahl räumlich verteilter Erhaltungsgebiete notwendig. Die Auswahl der Flächen muss mit den räumlichen Verteilungsmustern genetischer Diversität übereinstimmen.
In Anlehnung an die räumliche Untergliederung eines Biosphärenreservates (Batisse1986) unterteilenMaxtedet al. (1997) ein genetisches Erhaltungsgebiet in eine Kern-, Puffer- und Übergangszone:
- In den Kernzonen , in der die zu schützende Population wächst, sind ausschließlich Maßnahmen erlaubt, die der Erhaltung und nachhaltigen Nutzung der Population dienen. Dazu gehören das Monitoring von Veränderungen des Habitats, der demographischen Zusammensetzung des Vorkommens und, sofern angezeigt, Untersuchungen zur Veränderung der genetischen Diversität. Durch die Entnahme eines Saatgutmusters am Wuchsort und die Einlagerung als Akzession in der Genbank für Wildpflanzen für Ernährung und Landwirtschaft (WEL) wird das Vorkommen zusätzlich ex situ gesichert. Die Akzession kann für populationsverstärkende Maßnahmen sowie für die Abgabe von Material für Forschung und Entwicklung verwendet werden.
- Die Kernzonen sind Bestandteil einer sie umfassenden Pufferzone . In der Pufferzone sind Nutzungsaktivitäten zulässig, soweit sie dem Schutzziel nicht entgegenstehen.
- Auch weil künftige Umweltveränderung die Wachstumsbedingungen innerhalb der Kernzonen verändern können, sollte eine Puffer- und Übergangszone vorgehalten werden, um die Migration der Art zu erleichtern.
Gen etische E rhaltungs g ebiete können (GenEG) auf verschiedenen geographischen Skalenebenen ausgewiesen werden. So fordert Planta Europa (2008) im Ziel 9.1 die flächendeckende Ausweisung von GenEG für die 25 wichtigsten europäischen Zentren der WVK-Artenvielfalt. Die Frage, wie auf dieser Skalenebene (mehrere Hundert Quadratkilometer) Kern-, Puffer- und Übergangszonen zu gestalten sind und ausgewählte Populationen einer größeren Anzahl von Arten gemäß der Definition vonMaxtedet al. (1997) aktiv bewirtschaftet werden können, blieb bisher unbeantwortet. Im Verlauf des GE-Sell-Projektes zeigte sich, dass der Vorschlag vonMaxtedet al. (1997) zur Gestaltung eines GenEG als Anregung zu verstehen ist und an die Fachpraxis angepasst werden muss.
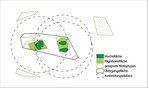
Ein modifiziertes Modell des GenEG für Wildselleriearten (Abb. 2) wurde auf der Grundlage einer Schutzkonzeption vonLaguna(2001) entwickelt. Er verwendet für die Erhaltung gefährdeter Arten in der Provinz Valencia (Spanien) „micro-reserves“. Hierbei handelt es sich um Flächen, die nach einer gesetzlich festgelegten Definition kleiner als 20 ha sind und mindestens ein Vorkommen einer gefährdeten Art enthalten (Laguna2001). Das Netzwerk von GenEG einer Wildsellerieart kann in Anlehnung anLaguna(2001) aus mehreren über das Verbreitungsareal der Art verteilte kleinere Flächen mit je einem Vorkommen bestehen. Die räumliche Gestalt und Untergliederung eines individuellen GenEG ergibt sich aus der Lage der Wuchsfläche des ausgewählten Vorkommens und der Lage besiedlungsfähiger Biotope innerhalb der Ausbreitungsdistanz der Zielart.
In Abb. 2 ist eine aus drei Teilpopulationen bestehende Meta-Population dargestellt:
- Die Wuchsflächen der Zielart befinden sich in der (den) Migrationsfläche(n) . Die Migrationsfläche stellt einen Bereich im Biotop dar, der für das Wachstum einer Art grundsätzlich geeignet ist. Sie kann von der Art besiedelt werden, falls sich die Wachstumsbedingungen auf den Wuchsflächen verschlechtern.
- Die Übergangsfläche umfasst alle geeigneten und dazwischen liegenden ungeeigneten Biotoptypen innerhalb der Ausbreitungsdistanz sowie die Migrationsflächen und alle Wuchsflächen.
- Die äußere genetische Grenze des GenEG wird durch die Ausbreitungsdistanz einer Art bestimmt.
Falls sich das GenEG innerhalb eines Naturschutzgebietes (NSG) befindet, kann das Polygon der Übergangsfläche als formale Grenze eines GenEG im Zuge der Überarbeitung einer NSG-Verordnung festgelegt werden. Auf der Wuchsfläche sind alle Handlungen zu unterlassen, die den Zustand des Teilvorkommens beeinträchtigen, in der Migrationsfläche sind alle Handlungen zu unterlassen, die eine künftige Besiedlung durch die Art verhindern, und in der Übergangsfläche sind Handlungen zu unterlassen, die den Genfluss zwischen Teilen der Meta-Population behindern. Geeignete Biotoptypen und weitere Vorkommen der Art können sich auch außerhalb der Ausbreitungsdistanz bzw. Grenze der Übergangsfläche befinden.
Die Ausbreitungsdistanz ist von der Bestäubungsart (Anemophilie, Zoophilie) und den Mechanismen der Samenverbreitung (Anemochorie, Epizoochorie oder Hydrochorie) und den örtlichen Gegebenheiten (z.B. Stand- oder Umtriebsbeweidung, stehende Gewässer oder Fließgewässer) abhängig und ist am konkreten Fallbeispiel zu ermitteln.
3 Vorbereitende Arbeiten
Die Planung eines Netzwerkes GenEG nach dem monographischen Lösungsansatz beginnt mit der Auflistung aller Wildarten, die mit der Kulturart mehr oder weniger verwandt und somit grundsätzlich von züchterischem Interesse sind. Der taxonomische und phylogenetische Wissensstand sowie Informationen zur Ökologie der Arten, zum Gefährdungsstatus, zur geographischen Verbreitung, zur Kreuzbarkeit der Arten, zur genetischen Diversität und zu züchterisch relevanten Eigenschaften der Arten werden zunächst zusammenfassend dargestellt.
3.1 Taxonomie, Verbreitung und Gefährdungsstatus
Die Ausführungen in diesem und im nachfolgenden Abschnitt konzentrieren sich auf Wildselleriearten des europäischen Diversitätszentrums. Im Abschnitt „Eigenschaften und Kreuzbarkeit“ werden dagegen alle Arten des Genpools, d.h. auch Arten der südlichen Erdhalbkugel, mitberücksichtigt. Von den 20 bis 25 Wildselleriearten (Ronseet al. 2010) kommen in Europa sechs Arten vor (Tab. 1). Alle Arten der Gattung Helosciadium bilden eine monophyletische Gruppe mit der Untergruppe 1 ( H. nodiflorum, H. bermejoi (L. Llorens) Popper & M. F. Watson und H. repens ) sowie der Untergruppe 2 ( H. inundatum und H. crassipes W. D. J. Koch).
A. graveolens ist die einzigeApium -Art des europäischen Diversitätszentrums. Sie steht in phylogenetischer Hinsicht der Naufraga balearica Constance & Cannon nahe, die als endemische Art nur auf Mallorca vorkommt und stark gefährdet ist (Moreno Saiz2011).
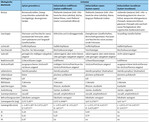
In Deutschland werden die vier heimischen Wildselleriearten je nach Bundesland in die Gefährdungskategorie ausgestorben oder verschollen, vom Aussterben bedroht, stark gefährdet oder gefährdet eingeordnet (BfN 2017). In Tab. 1 ist der Erhaltungszustand der Arten nach IUCN-Kriterien (Bilzet al. 2011) und den deutschen Rote-Liste-Kriterien sowohl für Deutschland insgesamt (BfN 2017) als auch differenziert nach Bundesländer dargestellt (BreunigundDemuth1999,BVNH2008,Franket al. 2004,Garve2004,Korsch &Westhus2010,LUW2015,Mierwaldet al. 2006,Poppendieket al. 2010,Raabeet al. 2010,Ristowet al. 2006,Schneideret al. 2008,Schulz2013,Seitzet al. 2018, Voigtländer&Henker2005).
3.2 Ökologische Ansprüche
Die „Dispersal and Diaspore Database” (Hintzeet al. 2013) enthält Angaben zur relativen Bedeutung der Anemochorie, Hydrochorie und Epichorie für die Ausbreitung der Arten A. graveolens, H. nodiflorum und H. repens (Tab. 2). Information zur Ausbreitungsweise der Art H. inundatum sind in dieser Datenbank noch nicht vorhanden.
Detaillierte Informationen zu biologisch-ökologischen Merkmalen der vier heimischen Arten bietet BIOLFLOR (Klotzet al. 2002). In diesem Abschnitt werden deshalb nur die Standortansprüche der Arten skizziert:
- A. graveolens kommt auf feuchten Standorten an den Küsten Europas und auf Binnensalzstellen vor.
- H. nodiflorum findet man auf nassen Standorten, insbesondere im Böschungs- und Verlandungsbereich von Fließgewässern. Teilweise ist H. nodiflorum flutend in Bächen anzutreffen.
- H . repens ist eine Art, die auf feuchten Weiden, im Uferbereich ohne Gehölze und am Rand kleiner, langsam fließender Gewässer vorkommt.
- H. inundatum ist Teil der Heidetümpelvegetation und kann ebenso wie H. repens als aquatische Form auftreten.
3.3 Eigenschaften und Kreuzbarkeit
Die wirtschaftliche Bedeutung einer Eigenschaft sowie für die Einkreuzung der Eigenschaft in die Kulturart erforderlichen Investitionen bestimmen den Wert einer Art als pflanzengenetische Ressource. Je nach Ausprägung der Kreuzungsbarriere zwischen der Kulturart und der Wildart werden Wildarten in den primären (GP1, keine oder sehr schwache Kreuzungsbarrieren), sekundären (GP2, ausgeprägte Kreuzungsbarrieren) und tertiären (GP3, Überwindung von Kreuzungsbarrieren sehr schwierig) G en p ool einer Kulturart eingeordnet (Harlanundde Wet1971). NachQuiros(1993) undRonseet al. (2010) gehören einschließlich der wildwachsenden Urform des Kulturselleries elf Apium - und sechs Helosciadium -Arten zum globalen Genpool.
Unterschiedliche Chromosomenzahlen in den Ausgangseltern können die Fertilität interspezifischer Hybriden beeinträchtigen und die Entstehung von Arthybriden verhindern. Deshalb sind Informationen zur Chromosomenzahl der Arten von Interesse. Mit Ausnahme von N. balearica (2n = 20 plus 1-2) (CastroundRoselló2005) sind alle Arten des Kultursellerie-Genpools diploid mit 2n = 22 Chromosomen (Constanceet al. 1976,Short1979). Für H. crassipes konnte keine Angabe gefunden werden.
A. panul Reiche und A. chilense Hook. & Arn. sind wichtige Quellen für die Züchtung auf Resistenz gegen die Septoria -Blattfleckenkrankheit ( Septoria apicola Speg. f.s. apii ).Ochoa&Quiros(1989) kreuzten deshalb beide Arten mit A. graveolens und entwickelten anschließend Rückkreuzungs-Nachkommenschaften mit A. chilense als Komponente (Trumbleet al. 2000). A. prostratum Labill. ex Vent ist resistent gegen Spodoptera exigua Hübner (ein Eulenfalter), dessen Raupen durch Skelettierfraß Schäden an Blättern verursachen (Diawaraet al. 1992). H. nodiflorum zeichnet sich durch eine Resistenz aus, die die Entwicklung der Blattminierfliege Lyriomiza trifolii Burgess über das Larvenstadium hinaus sehr wirkungsvoll unterbindet (Trumbleet al. 1990, 2000).
Nachkommenschaften von A. chilense x A. panul erwiesen sich als voll fertil, was auf eine nahe Verwandtschaft beider Arten hinweist (Ochoa&Quiros1989). Nach den Berichten vonQuiros(2010) zeigen F1-Pflanzen von A. graveolens x A. chilense und A. graveolens x A. prostratum in unterschiedlichem Maße Fertilitätsstörungen, die jedoch nicht die Erzeugung von Rückkreuzungs-Nachkommenschaften verhindern. Nach der Definition vonHarlan&de Wet(1971) handelt es sich demnach um ausgeprägte Kreuzungsbarrieren und eine Einordung beider Wildarten in den sekundären Genpool erscheint daher gerechtfertigt. Kreuzungen zwischen der Kulturform und H. nodiflorum waren bislang nicht erfolgreich (Pinket al. 1983). H. inundatum x H. nodiflorum führt zur sterilen Hybridart A. x moorei (Syme) Druce, die als Art nicht anerkannt wird (Ronseet al. 2010). Phylogenetisch stehen die H. bermejoi , H. repens , H. inundatum und H. crassipes der Art H. nodiflorum (Downieet al. 2000) nahe . Deshalb ist die vorläufige Zuordnung dieser Arten zum tertiären Genpool angebracht. Die Einteilung ist nachstehend zusammengefasst.
- GP1: A. graveolens (Kulturformen, GP1-A) und A. graveolens (Wildform, GP1-B);
- GP2: A. panul, A. chilense, A. prostratum und N. balearica ;
- GP3: H. nodiflorum , H. bermejoi , H. repens , H. inundatum und H. crassipes .
3.4 Ökonomische und ökologische Bedeutung
Sellerie erfreut sich weltweit zunehmender Beliebtheit und so stieg der Gesamtproduktionswert für Sellerie in den USA auf 458 Millionen US$ im Jahr 2013 (AgMRC2017). Die Anbaufläche in der EU-28 betrug im Zeitraum von 2011 bis 2016 durchschnittlich 8 125 ha (EU 2017). In Deutschland entsprach die Sellerieanbaufläche mit 1 995 ha rund 1,76 % der Gesamtfläche des Freilandgemüseanbaus (Hortipendium 2017). Diese Daten zeigen, dass der Kultursellerie eine begrenzte, aber dennoch weltwirtschaftliche Bedeutung besitzt.
Für die Wildarten der Gattung Helosciadium existiert ein kleiner Saat- und Pflanzgutmarkt für Hobbygärtner. H. nodiflorum wird vom Handel als Sedanina bezeichnet und gilt wie der Kriechende Sellerie als aromatisches Blattgemüse. H. repens wird als winterharter Petersilienersatz vom Saatguthandel angeboten.
Die Wildselleriearten sind nicht nur als genetische Ressource von Interesse. NachKara(2014) nimmt H. nodiflorum weitaus mehr Nickel (Faktor 20) und Kupfer (Faktor 100) auf als das Raue Hornblatt ( Ceratophyllum demersum ). H. nodiflorum könnte sich somit zur Reinigung schwermetallbelasteter Fließgewässer eignen.
4 Aufbau eines Netzwerkes
Die vorbereitenden Arbeiten enden mit der Auswahl von Arten, für die der Aufbau von GenEG besonders wichtig ist. Der Genpool des Kulturselleries umfasst nur vier in Deutschland heimische Arten, die in unterschiedlichem Maße gefährdet sind. Aufgrund ihrer Gefährdungssituation und der Tatsache, dass der Kriechende Sellerie (Apium repens ) in den Anhängen II und IV der Fauna-Flora-Habitat-Richtlinie geführt wird, besteht ohnehin Handlungsbedarf. Insofern ist eine Prioritätensetzung bei der Artenauswahl nach formalen Entscheidungskriterien (vgl.Maxtedet al. 1997) nicht erforderlich.
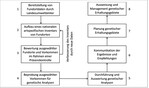
Die Auswahl von Vorkommen einer Art und die Ausweisung ihrer Standorte als genetische Erhaltungsgebiete erfolgen in acht Schritten, die in Abb. 3 dargestellt sind. Diese umfassen die Bereitstellung von Fundortdaten durch die Landesumweltämter oder Landesbetriebe bzw. Stellen für floristische Kartierung (1). Nach Aufbereitung der heterogenen Datensätze und dem Aufbau eines harmonisierten Gesamtdatensatzes entsteht das nationale, artspezifische Inventar von Fundorten, welches ergänzt (Neufunde) und korrigiert (Verlust von Vorkommen) wird (2). Die Auswahl von Vorkommen für die anschließende Präsenzkontrolle ausgewählter Vorkommen erfolgt nach ökogeografischen Kriterien. Im Zuge der Präsenzkontrolle wird der Wuchsort anschließend hinsichtlich seiner Eignung als GenEG begutachtet und bewertet (3).
Auf positiv bewerteten Wuchsorten werden Proben der Zielart für genetische Analysen gesammelt (4) und analysiert (5). Die Ergebnisse genetischer Analysen sind neben wirtschaftlichen (Personalkapazität vor Ort) und sozialen (Unterstützung durch Menschen vor Ort)ein Kriterium für die Auswahl von Vorkommen für den Aufbau eines GenEG (6). Nach der Auswahl geeigneter Flächen und Vorkommen erfolgt die Planung des GenEG. Diese betrifft die genaue räumliche Lage (Grenzen der Wuchs-, Migrations- und Übergangsfläche), die Änderung oder Aufstellung von Pflegeplänen, die Klärung rechtlicher Fragen und die Sicherstellung von Personalkapazitäten oder Auftragsmittel für die Durchführung von Pflegemaßnahmen und des Monitorings (7). Abschließend erfolgt die Ausweisung eines GenEG (8).
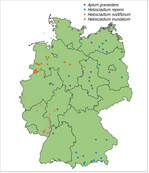
Im GE-Sell-Projekt wurden die Schritte 1 bis 4 bereits vollzogen und Schritt 5 vorbereitet. Die Umweltämter der Länder übermittelten Informationen zu 2 400 Vorkommen der Wildselleriearten A. graveolens ssp. graveolens , H. repens, H. nodiflorum und H. inundatum . Auf dieser Grundlage wurden Vorkommen ausgewählt und von regionalen Experten begutachtet.
- A. graveolens wurde an 84 von 116 aufgesuchten Standorten bestätigt. Die Vorkommen verteilen sich auf neun Bundesländer.
- Bei H. repens wurden im Jahr 2015 in sieben Bundesländern insgesamt 78 Standorte aufgesucht. Bei 59 davon konnte die Art aufgefunden werden.
- H. nodiflorum konnte an 42 der 51 aufgesuchten Standorte, die sich über vier Bundesländer verteilten, erfasst werden.
- Bei H. inundatum sind 120 Standorte in sechs Bundesländern aufgesucht worden. Bei lediglich 54 war die Art präsent.
Anhand der räumlichen Verteilung und der Bestandsgröße sowie der Empfehlung regionaler Experten vor Ort wurden im Anschluss zirca 25 Vorkommen pro Art ausgewählt, die potenziell für die Einrichtung eines GenEG geeignet sind. Um beurteilen zu können, mit welchen dieser Vorkommen die größtmögliche genetische Diversität erhalten werden kann, entnahmen regionale Experten in Abstimmung mit den zuständigen Behörden und Gebietsbetreuern im Jahr 2016 Blattproben für genetische Analysen (Abb. 4).
Im gleichen Zeitraum wurden genetische Marker für die Analyse genetischer Diversität der vier Wildselleriearten erprobt bzw. entwickelt.Acquadroet al. (2006) undFuet al. (2013, 2014) veröffentlichten für A. graveolens Primersequenzen zu SSR-Markern (SSR= Simple Sequence Repeats). Hierbei handelt es sich um kurze, nichtcodierende DNA-Sequenzen mit einer Länge von zwei bis sechs Nukleotiden, sogenannte Motive, die gleichmäßig im Genom einer Art verteilt sind und genotypspezifische Unterschiede hinsichtlich der Anzahl wiederholter Motive aufweisen. In diesem Fall spricht man von polymorphen SSR-Markern, mit denen sich genetische Unterschiede zwischen Individuen innerhalb eines Vorkommens und zwischen Vorkommen innerhalb eines Verbreitungsgebietes ermitteln lassen. Am Julius Kühn-Institut wurden 40 Primersequenzen für A. graveolens an jeweils zehn Individuen aus drei Vorkommen getestet. Es konnten 16 polymorphe und informative SSR-Marker identifiziert werden, die für die Analyse genetischer Diversität bei A. graveolens geeignet sind.
Abgesehen von einigen genetischen Markern für H. repens (Bruns&Friesen2014) fehlten SSR-Marker für jede der drei Helosciadium -Arten. Deshalb wurde ein Biotechnologie-Unternehmen mit der Entwicklung von 120 SSR-Markern beauftragt. Bislang konnten elf polymorphe Marker für H. repens , 18 polymorphe Marker für H. nodiflorum und 16 für H. inundatum identifiziert werden, die sich für die Analyse genetischer Diversität eignen.
Mit dem Abschluss der statistischen Auswertung der Markerdaten beginnt die entscheidende Phase des Projektes: die Ausweisung individueller GenEG und die Gründung eines Kooperationsverbundes. Aus Sicht potenzieller Kooperationspartner ist die Einrichtung und das dauerhafte Management eines GenEG ein Vorhaben, welches das eigene berufliche und/oder wirtschaftliche Handeln beeinflussen kann. Mit der Ausweisung von GenEGs kann sich das Aufgabenspektrum der Landesumweltämter, der unteren Naturschutzbehörden und vergleichbarer Organisationen vergrößern. Sofern notwendig können darüber hinaus Veränderungen der Flächennutzung die Interessen von Personen berühren, die das Gebiet gegenwärtig nutzen. Die Partner des GE-Sell-Projektes orientieren sich daher an den Grundsätzen der partizipatorischen Projektplanung (Feige2003). Die bisherigen Erfahrungen des Projektteams waren überaus positiv. Die Gesprächspartner äußerten eine grundsätzliche Bereitschaft zur Mitwirkung. Kritische Anmerkungen bezogen sich in der Regel auf Fragen der Finanzierung und des dauerhaften Managements von GenEG. Ferner schlugen Gesprächspartner vor, am Betrieb von GenEG beteiligte Partner z.B. durch ein Logo für GenEG auszuzeichnen. Diese Anregung wurde bereits vom Bundesministerium für Ernährung und Landwirtschaft (BMEL) aufgegriffen. Inzwischen steht ein Logo zur Verfügung (Abb. 5).
Allen Gesprächspartnern ist bewusst, dass der Aufbau eines GenEG ein individuelles Vorhaben mit den Phasen Vorbereitung, Durchführung und Abschluss darstellt (Feige2003). Zum Ende hin muss das Vorhaben in eine Organisationsform überführt werden, die ein dauerhaftes Management des GenEG gewährleistet. Zu diesem Zweck wurde eine Kooperationsvereinbarung entworfen und mit potenziellen Verbundpartnern erörtert. Mit der Unterzeichnung der Kooperationsvereinbarung werden die Verbundpartner Teil eines bundesweiten Netzwerkes genetischer Erhaltungsgebiete für Wildselleriearten und zugleich Teil des geplanten „Netzwerk Genetische Erhaltungsgebiete in Deutschland“ (BLE 2017).
5 Erfolgskontrolle
Eine Projektsteuerung ist nicht nur während der Aufbauphase eines Netzwerkes notwendig, sondern während der gesamten Existenzdauer einer Netzwerkorganisation. Steuerungsmaßnahmen betreffen zwei grundsätzlich verschiedene Aspekte, und zwar die Funktion (a) der Netzwerkorganisation und (b) des individuellen GenEG.
Netzwerkorganisationen sind dynamischer Natur, denn sie sind aufgrund personeller Veränderungen in der Mitgliedschaft einem beständigen Wandel unterworfen. Maßnahmen zur In-situ-Erhaltung von WVK stehen darüber hinaus in Konkurrenz mit den Zielen anderer Flächennutzer. So wie bei allen langfristig angelegten Projekten können Zielkonflikte entstehen, die unter Umständen nur zulasten von GenEG gelöst werden und zum Verlust einzelner Gebiete führen können. Die Funktionsfähigkeit eines Netzwerkes (auf Bundesebene) lässt sich u.a. danach beurteilen, inwieweit der Verlust durch die Ausweisung neuer GenEG kompensiert wird, d.h. ob das Netzwerk das Übernommene nur verwaltet oder aktiv weiterentwickelt. Dafür könnte künftig das Informations- und Koordinierungszentrum für Biologische Vielfalt an der Bundesanstalt für Landwirtschaft und Ernährung (BLE-IBV) zuständig sein, wie vonFreseet al. (2017) vorgeschlagen.
Die Auswirkung von Managementmaßnahmen auf den Zustand von Vorkommen der Zielart ist ein weiteres Kriterium, anhand dessen sich der Erfolg eines Netzwerkes bemessen lässt. Diese Maßnahmen sind individuell auf das jeweilige Vorkommen und die Fläche zugeschnitten. Der Zustand eines einzelnen Vorkommens kann mit den Methoden des demographischen Monitorings bewertet werden. Parameter des demographischen Monitorings sind Populationsgröße und Populationsdichte oder, alternativ, die Frequenz und Flächendeckung der Zielart innerhalb von Beobachtungsparzellen (zur Methode für H. repens sieheLederbogenet al. 2004). Die Veränderung der Populationsstruktur (Zusammensetzung des Vorkommens aus definierten Altersstadien) im zeitlichen Verlauf ist ein weiterer Parameter zur Darstellung des Erhaltungszustandes (Iriondoet al. 2008). Damit verbundene Datenerfassungen im Gelände sind nicht nur zeitaufwändig, sondern setzen auch artspezifisches Fachwissen voraus. Die Erfassung dieser planungsrelevanten Fachdaten fällt deshalb in den Aufgabenbereich der Naturschutzverwaltungen bzw. von ihnen beauftragten Unternehmen.
Dies gilt in noch stärkerem Maße für die Planung und Durchführung des genetischen Monitorings. NachIriondoet al. (2008) ist genetisches Monitoring nur dann anzuwenden, falls das demographische Monitoring einen fortschreitenden Verlust der reproduktiven Fitness anzeigt und Maßnahmen zur Populationsstärkung geplant und ausgeführt werden müssen. Genetisches Monitoring ist nicht nur in methodischer Hinsicht aufwändiger als das demographische, sondern erfordert eine spezielle Ausstattung und spezielles Fachwissen auf dem Gebiet des methodischen Einsatzes genetischer Marker, der statistischen Auswertung sowie der Ergebnisinterpretation.
Die Ausweisung eines genetischen Erhaltungsgebietes schließt definitionsgemäß die Konservierung einer Saatgutprobe des betreffenden Vorkommens in einer Genbank ein. Die Erfolgskontrolle umfasst daher auch die regelmäßige Überprüfung der Keimfähigkeit, die ein bestimmtes Niveau nicht unterschreiten sollte, und die Menge keimfähiger Samen im Bestand. Bereits bei der Aufnahme muss diese in eine Originalprobe für gegebenenfalls erforderliche populationsverstärkende Maßnahmen und in eine Probe für die Saatgutreproduktion am Standort der Genbank unterteilt werden. Ausschließlich das Vermehrungsmaterial sollte als genetische Ressource für Ernährung und Landwirtschaft für Forschung und Entwicklung an Nutzer abgegeben werden. Zu einem voll funktionsfähigen Netzwerk genetischer Erhaltungsgebiete gehören somit auch dauerhaft finanzierte Genbanken, die die internationalen Genbankstandards (FAO2014) einhalten können.
6 Datenfluss und Informationssysteme
Seit Januar 2016 stehen Informationen zum GE-Sell-Projekt öffentlich auf netzwerk-wildsellerie.julius-kuehn.de/ zur Verfügung. Die Webseite ist mit einem Informationsangebot der BLE-IBV vernetzt, um zu verdeutlichen, dass das künftige Netzwerk genetischer Erhaltungsgebiete für Wildselleriearten als eine Komponente des Netzwerks Genetischer Erhaltungsgebiete in Deutschland entwickelt wird.
Im Rahmen des GE-Sell-Projektes erhobene Daten werden im Botanischen Kartierungsportal des Botanischen Gartens der Universität Osnabrück in einem neu entwickelten Modul gespeichert und kartenbasiert dargestellt ( vm323.rz.uos.de/mapportal/ ). Die GE-Sell-Daten sind nur mit Zugangsberechtigung einsehbar. Das Modul soll auch nach Abschluss des Modell- und Demonstrationsvorhabens das Netzwerk genetischer Erhaltungsgebiete für Wildselleriearten unterstützen. Allen Beteiligten ist jedoch bewusst, dass damit verbundene Aufgaben nicht allein durch die Einwerbung von Drittmitteln erledigt werden können.
Die Zuständigkeiten für die Erhebung und Dokumentation von Daten sind eindeutig geregelt, sofern es sich um Daten handelt, die innerhalb naturschutzrechtlich geschützter Gebiete erhoben werden. Im Rahmen von Gutachten und Projekten auf diesen Flächen neu erhobene Daten sind an die zuständigen Landesbehörden zu übermitteln. Eine wesentliche Hürde im Hinblick auf die Ausweisung von GenEG ist die noch ungeklärte Frage, welche Institution künftig für den Aufbau und den langfristigen Betrieb von Informationssystemen für das Monitoring von WVK und ihrer Populationen verantwortlich ist und diese Funktion auch in personeller Hinsicht untersetzen kann.
Dank
Das Projekt GE-Sell wird vom Bundesministerium für Ernährung und Landwirtschaft (BMEL) über die Bundesanstalt für Landwirtschaft und Ernährung (BLE), Bonn, Förderkennzeichen 2814BM110, gefördert.
Literatur
Aus Umfangsgründen steht das ausführliche Literaturverzeichnis unter www.nul-online.de (Webcode NuL2231) zur Verfügung.
Fazit für die Praxis
Die Auswahl von Vorkommen und Flächen für den Aufbau genetischer Erhaltungsgebiete für Wildlebende Verwandte von Kulturarten (WVK) erfolgt in acht Schritten. Dabei entstehen Produkte, die auch für die Naturschutzpraxis von Nutzen sind, u.a.
Darüber hinaus kann das Netzwerk genetischer Erhaltungsgebiete für Wildsellerie auf der Grundlage der europäischen Konzeption zur In-situ-Erhaltung pflanzengenetischer Ressourcen und mit Unterstützung des Europäischen Kooperationsprogrammes für pflanzengenetische Ressourcen (ECPGR) zu einem europäischen oder globalen Netzwerk ausgebaut werden.
Kontakt
Dr. rer. hort Lothar Frese leitet die Abteilung pflanzengenetische Ressourcen des Instituts für Züchtungsforschung an landwirtschaftlichen Kulturen am Julius Kühn-Institut – Bundesforschungsinstitut für Kulturpflanzen (JKI) in Quedlinburg. Zuvor arbeitete er als Züchtungsforscher und Genbankexperte in Braunschweig und Wageningen (Niederlande). Im Jahr 1996 übernahm er die Leitung der ehemaligen Braunschweiger Genbank. Arbeitsschwerpunkte: In-situ-Erhaltung, genetische Vielfalt, europäische Zusammenarbeit.
> lothar.frese@julius-kuehn.de
M. Sc. Maria Bönisch koordiniert das Modell- und Demonstrationsvorhaben „Genetische Erhaltungsgebiete für Wildselleriearten (Apium undHelosciadium ) als Bestandteil eines Netzwerkes genetischer Erhaltungsgebiete in Deutschland“ (GE-Sell) am Institut für Züchtungsforschung an landwirtschaftlichen Kulturen des Julius Kühn-Instituts – Bundesforschungsinstitut für Kulturpflanzen (JKI). Studium der Geoökologie und Ökologie, Evolution und Naturschutz an der Universität Potsdam.
> maria.boenisch@julius-kuehn.de
M. Sc. Tobias Herden promoviert im Fachbereich Biologie der Universität Osnabrück auf dem Gebiet Botanik. Im Modell- und Demonstrationsvorhaben „GE-Sell“ ist er für die genetischen Analysen vonH. repens zuständig. Studium der Biologie der Organismen an der Universität Osnabrück. Seit 2009 in der Arbeitsgruppe von Dr. Nikolai Friesen am Botanischen Garten der Universität Osnabrück im BereichAllium tätig.
> tobias.herden@biologie.uni-osnabrueck.de
Dr. Matthias Zander , Albrecht Daniel Thaer-Institut für Agrar- und Gartenbauwissenschaften an der Humboldt-Universität zu Berlin
> matthias.zander@agrar.hu-berlin.de
Dr. Nikolai Friesen , Botanischer Garten der Universität Osnabrück
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen



Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.