Reproduktionshabitate und Phänologie des Segelfalters im Mittelrheintal
Abstracts
Die vorliegende Arbeit befasst sich mit den Reproduktionsstandorten und der Phänologie des hessenweit stark gefährdeten Segelfalters ( Iphiclides podalirius ) in der Gemarkung Assmannshausen (Rheingau-Taunus-Kreis, Weltkulturerbe Oberes Mittelrheintal). Durch die historische Bewirtschaftung entwickelte sich hier im Laufe der Zeit eine vom Menschen geprägte Kulturlandschaft. Ein Teil der Flächen unterliegt aufgrund der zunehmenden Nutzungsaufgabe seit einigen Jahren der natürlichen Sukzession, wodurch weite Teile der ehemals verbreiteten Magerrasen verbuschten und die Niederwälder durchwuchsen.
Die Ergebnisse dieser Arbeit zeigen, dass der Segelfalter eine wärmeliebende Art ist, die zur Reproduktion vor allem auf trocken-heiße, sonnenexponierte Standorte mit Steinweichseln ( Prunus mahaleb ) angewiesen ist, wie sie beispielsweise an Trockenmauern oder auf lückigen Magerrasen vorkommen. Auf Grundlage dieser Ergebnisse werden konkrete Pflegevorschläge zur Optimierung der bestehenden Habitate abgeleitet, wie die Wiederherstellung und Offenhaltung von Magerrasen.
The Scarce Swallowtail in the Middle Rhine Valley – reproduction habitats and phenology. Management suggestions for a historical cultural landscape
The paper presents the habitats of reproduction and the phenology of the endangered Scarce Swallowtail within the district Assmannshausen (District Rheingau-Taunus, UNESCO World Heritage ‘Upper Middle Rhine Valley’). The historical management and land use in this area has created a cultural landscape which is characterised by human intervention. During the last decades, many farmers have abandoned cultivation, which has led to widespread natural succession.
The results of this paper show that the Scarce Swallowtail is a thermophilic species, which depends on hot and dry rock with Mahaleb Cherry trees. They can be found on dry stone walls or on nutrient-poor grassland patches with scarce vegetation. On this basis the paper provides detailed management suggestions to improve the existing habitats, such as the restoration and protection of nutrient-poor grassland.
- Veröffentlicht am

1 Einleitung
Der Umbruch von der traditionellen zur industrialisierten Landbewirtschaftung hat erhebliche Veränderungen in der Kulturlandschaft Mitteleuropas hervorgerufen. Durch den vermehrten Einsatz von Mineraldünger ab den 1950er-Jahren und den anhaltenden technischen Fortschritt konnte die Nutzung auf den meisten landwirtschaftlich genutzten Flächen zunehmend intensiviert werden. Gleichzeitig ist die Bewirtschaftung auf vergleichsweise unproduktiven Grenzertragsstandorten vermehrt aufgegeben worden. Diese Entwicklungen haben zum Verschwinden bzw. zur Fragmentierung vieler Lebensräume und damit auch zum Rückgang der auf diese Lebensräume angewiesenen Arten geführt (Fartmann2017,Poschlod2015).
In zunehmender Intensität verändert seit Ende des letzten Jahrtausends auch der Klimawandel durch zunehmende Frühjahrstrockenheit, eine erhöhte Wahrscheinlichkeit für das Eintreten extremer Wetterereignisse und den Anstieg der Jahresmitteltemperatur viele Lebensräume und bedroht damit die Biodiversität (Fartmann2017). Trotz der Zunahme der Jahresmitteltemperatur nehmen warme Mikrohabitate, auf die viele Tagfalterarten zur Reproduktion angewiesen sind, jedoch ab. Das liegt im Falle der Grenzertragsstandorte vor allem daran, dass offene und magere Flächen infolge ausbleibender Nutzung verbuschen. Dies führt zu einer Beschattung, wodurch geeignete Larvalhabitate nach und nach verloren gehen.
Meist sind die Larvalhabitate von Tagfaltern artspezifisch und anhand der genutzten Strukturen räumlich gut abgrenzbar. Das bloße Vorhandensein der Wirtspflanze reicht zur erfolgreichen Reproduktion einer Art in aller Regel nicht aus. Damit sich das Ei eines Tagfalters erfolgreich bis zum Falter entwickeln kann, muss das Larvalhabitat in der Regel eine Reihe wichtiger Eigenschaften aufweisen. Dazu zählen nachFartmann&Hermann(2006)
- ein geeignetes Mikroklima,
- Wirtspflanzen in einem phänologisch geeigneten Zustand,
- ein ausreichendes Angebot an qualitativ guter Nahrung,
- die Erreichbarkeit durch begattete Weibchen,
- eine angemessene Flächenbewirtschaftung,
- geringen Konkurrenz-, Prädations- und Parasitoidendruck sowie
- bei obligat myrmekophilen Arten eine ausreichende Dichte der spezifischen Wirtsameisen.
Die Struktur eines Biotops und damit das Mikroklima spielen die größte Rolle für die Auswahl des Eiablageplatzes, wobei das Mikroklima wiederum von Exposition, Neigung, Vegetationshöhe und -bedeckung sowie Ablagehöhe beeinflusst wird.
Der Segelfalter ( Iphiclides podalirius , ) ist eine Charakterart der Grenzertragsstandorte in klimatisch begünstigten Regionen und eignet sich daher als Zielart für Pflegemaßnahmen. NachKinkleret al. (1991) kommt er in Rheinland-Pfalz auf steilen, Südost-, Süd- und Südwest-exponierten Felsen, Weinbergsbrachen, Weinbergswegen, Halbtrocken- und Magerrasen vor. Zur Eiablage nutzt er vor allem kleinwüchsige Sträucher auf schütteren und skelettreichen Standorten des Xerobromion, auf Lesesteinriegeln und Trockenmauern. Das Mikroklima dieser Ablagestandorte ist geprägt durch eine lange Besonnungsdauer und das Wärmespeichervermögen des anstehenden Gesteins, das auch nachts die gespeicherte Wärme kontinuierlich abstrahlt (Kinkleret al. 1991,Leopold2001,Steineret al. 2007). Der Segelfalter leidet besonders unter der oben beschriebenen Verbuschung infolge von Nutzungsaufgaben, da das benötigte heiße Kleinklima durch zunehmende Beschattung verloren geht. Daher gilt der Segelfalter in Hessen als stark gefährdet.
NachKinkleret al. (1991) beginnt die Flugzeit der Falter in Rheinland-Pfalz am 15. April, erste Eier werden Mitte Mai abgelegt, woraus Ende Mai erste Raupen schlüpfen, die sich ab Ende Juni verpuppen. Aus diesen Puppen schlüpft ab dem 11. Juli die zweite Generation, die Mitte Juli erste Eier ablegt, woraus Anfang August erste Raupen schlüpfen.
Die vorliegende Studie setzt sich mit den Lebensraumansprüchen des Segelfalters im Mittelrheintal auseinander. Dazu werden genutzte Larvalhabitate, Eiablagepflanzen und Eiablagehöhen beschrieben. Außerdem wird die Phänologie des Segelfalters im Untersuchungsjahr 2017 dargestellt.
Auf Basis der Ergebnisse wird erläutert, welche Aspekte bei der gezielten Pflege und Entwicklung von Segelfalter-Lebensräumen beachtet werden müssen. Dazu werden konkrete Handlungsempfehlungen gegeben, die auf eine Stabilisierung und Ausweitung der besiedelten Habitate abzielen. Der Segelfalter steht dabei stellvertretend für eine Reihe weiterer Arten, die ebenfalls auf klimatisch begünstigte Mikrohabitate früher und mittlerer Sukzessionsstadien angewiesen sind.
2 Methode
2.1 Untersuchungsgebiet
Das Untersuchungsgebiet liegt in der Gemarkung Assmannshausen, die zur Stadt Rüdesheim am Rhein im Rheingau-Taunus-Kreis im südwestlichen Hessen gehört. Geprägt ist die Gegend vor allem durch den Rotweinanbau, aber auch die Tourismusbranche gehört zu den wesentlichen Wirtschaftszweigen der Region, da Assmannshausen im Weltkulturerbe „Oberes Mittelrheintal“ liegt. So verläuft eine große Zahl von Wanderwegen, wie beispielsweise der Rheinsteig, durch die Gemarkung Assmannshausen. Neben dem Weinbau ist die Forstwirtschaft heute eine der bedeutendsten Landnutzungsformen. Der Anteil an Acker und insbesondere auch an Grünland ist in der Gemarkung Assmannshausen sehr gering (HLNUG 2016).
Historisch gesehen sind die Wälder an den Rheinhängen der Region durch Niederwaldwirtschaft geprägt. Die dominierende Baumart Traubeneiche ( Quercus petraea ) wurde auf dem nährstoffarmen und skeletthaltigen Boden regelmäßig auf den Stock gesetzt, wodurch eine niedrigwüchsige und lückige Vegetation geschaffen wurde. Der Steillagen-Weinbau spielte seit dem Mittelalter eine große Rolle, was zusätzlich zur Offenhaltung der Landschaft beitrug. Außerdem gab es in der Gemarkung Assmannshausen einen Quarzit-Steinbruch, der inzwischen stillgelegt wurde und nun im Besitz der NABU-Stiftung Hessisches Naturerbe ist.
Diese Formen der Landnutzung formten eine historisch gewachsene Kulturlandschaft, die von vielen offenen, felsigen Bereichen und einer großen Strukturvielfalt auf kleinem Raum geprägt war. Dadurch wurden trocken-warme und magere Standorte mit ihrem charakteristischen Artenreichtum gefördert.
Die vegetationskundlich, ornithologisch und entomologisch wertvollen Flächen sind Teil der Naturschutzgebiete „Teufelskadrich bei Lorch“ und „Niederwald bei Rüdesheim“. Außerdem liegen sie innerhalb des Vogelschutzgebietes „Weinberge zwischen Rüdesheim und Lorchhausen“ und zum Teil innerhalb des FFH-Gebietes „Teufelskadrich bei Lorch“.
Große Teile der ehemals offenen Kulturlandschaft sind aufgrund fehlender Nutzung inzwischen verbuscht und die ehemaligen Niederwälder durchgewachsen. Vor diesem Hintergrund wurde im Rahmen einer Bachelorarbeit an der Technischen Hochschule Bingen anhand von Tagfalterkartierungen ein Pflegekonzept für die Rheinhänge bei Assmannshausen erstellt. Die Arbeit erfolgte in enger Abstimmung mit der NABU-Stiftung Hessisches Naturerbe, deren Flächen Teil des Untersuchungsgebietes sind. Da der hessenweit stark gefährdete Segelfalter im Untersuchungsgebiet vorkommt und seine Ansprüche stellvertretend für viele weitere Arten der frühen und mittleren Sukzessionsstadien stehen (vgl.Kinkleret al. 1991), sollte die Förderung geeigneter Reproduktionshabitate ein zentraler Baustein dieses Pflegekonzeptes sein. In der vorliegenden Studie wird der Schwerpunkt dieser Untersuchungen dargestellt.
2.2 Segelfalterkartierung
Die Segelfalterkartierungen erfolgten nach der bewährten Methode des Tagfalter-Monitorings Deutschland (Kühnet al. 2014). Schwer begehbare Abschnitte und kleinflächige Strukturen machten zusätzlich zur Linien-Transektkartierung auch das Kartieren anhand von Erfassungspunkten notwendig. Die Transekte und Erfassungspunkte wurden im Zeitraum vom 10.04.2017 in Kalenderwoche (KW) 15 bis zum 29.07.2017 in KW 30 jeweils ein Mal pro Woche begangen. Die Lufttemperatur betrug während den Begehungen mindestens 13 °C und die Windstärke maximal vier Beaufort. In den beiden Kalenderwochen 16 und 17 fand aufgrund eines Kälteeinbruchs pro Transekt nur eine Begehung statt. Im Zeitraum von 10.00 bis 17.40 Uhr wurden möglichst alle Segelfalter bestimmt. Von den Erfassungspunkten aus erfolgte die Kartierung in die Flächen hinein mit Hilfe eines Fernglases, das für einen Nahbereich von bis zu 1,2 m eingesetzt werden kann (Minox BF 8x42). Dabei wurde die jeweilige Struktur fünf Minuten lang untersucht und alle auf der Fläche vorkommenden Segelfalter erfasst.
2.3 Reproduktionsnachweise
Am 10.05., 16.05., 17.05., 22.05., 24.05. und 29.05.2017 wurde das Untersuchungsgebiet systematisch nach Präimaginalstadien des Segelfalters abgesucht. Dabei wurden alle Steinweichseln ( Prunus mahaleb ), Schlehen ( Prunus spinosa ) und Weißdorn-Arten ( Crataegus spec.) untersucht, an die herangegangen werden konnte. Stark verbuschte Bereiche konnten somit nur am Rand untersucht werden. Dabei wurde in allen erreichbaren Höhen mit möglichst gleichmäßiger Intensität gesucht, so dass von einer ähnlichen Erfassungsquote pro Blatt ausgegangen werden kann. Im Anschluss erfolgte die Erfassung der GPS-Koordinaten, eine Fotodokumentation und die Vermessung des Abstands der Eier und Raupen zur Geländeoberfläche mittels Zollstock.
3 Ergebnisse
3.1 Larvalhabitate
Der Segelfalter nutzte im Untersuchungsgebiet ausschließlich stark besonnte, trocken-heiße Mikrohabitate zur Eiablage. Neun von 32 Pflanzenindividuen, die zur Eiablage genutzt wurden, befanden sich auf Magerrasen mit lückiger Vegetation, die übrigen 23 Wirtspflanzen wuchsen auf Trockenmauern oder Lesesteinriegeln. Klar erkennbar ist also eine Bevorzugung von spärlich bis gar nicht bewachsenen Mikrohabitaten.
Die Spannweite der Hangexposition reichte von Süd-Ost über Süd und Süd-West bis hin zu West, wobei es sich bei der Westexposition nur um einen Einzelfund handelte.
Geeignete Bereiche, die vom Pestizideinsatz im Weinbau beeinflusst wurden, blieben erkennbar ungenutzt. In den Abb. 3–8 werden exemplarisch einige Larvalhabitate vorgestellt, die im Untersuchungsjahr vom Segelfalter genutzt wurden. Die Präimaginalstandorte sind mit roten Pfeilen gekennzeichnet.
Auf einem offenen Magerrasen, wie er in Abb. 6 dargestellt ist, gelang die Beobachtung der vollständigen Entwicklung eines Segelfalter-Exemplars an einer Steinweichsel ( Prunus mahaleb ) mit Krüppelwuchs.
3.2 Raupennahrungspflanzen
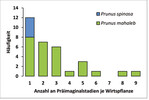
Im Untersuchungsgebiet dienten zwei Prunus -Arten als Wirtspflanzen: Die Steinweichsel bzw. Felsen-Kirsche ( P. mahaleb ) und die Schlehe ( P. spinosa ). An der Steinweichsel konnten an 28 Pflanzen insgesamt 82 Präimaginalstadien nachgewiesen werden, wohingegen an der Schlehe vier Nachweise mit jeweils einem Präimaginalstadium pro Pflanze gelangen.
Die Anzahl an Präimaginalstadien je Wirtspflanze kann Abb. 8 entnommen werden. Am häufigsten ist ein Präimaginalstadium pro Wirtspflanze. Die durchschnittliche Anzahl an Präimaginalstadien pro Wirtspflanze beträgt insgesamt 2,7. Im Vergleich der beiden Pflanzenarten finden sich an der Steinweichsel häufiger mehrere Gelege und Raupen.
Segelfalter legen durchaus mehrere Eier an besonders günstig exponierten Blättern ab. In Abb. 9 liegen zwei Eier frischen Stadiums vor, während die Eier in Abb. 10 zu unterschiedlichen Zeitpunkten an das Blatt geheftet wurden, da das untere, bläuliche Ei schon kurz vor dem Schlupf steht, während das obere, orangene Ei noch nicht so weit entwickelt ist.
Insgesamt ist im Untersuchungsgebiet also eine deutliche Bevorzugung der Steinweichsel erkennbar, während Schlehen trotz geeigneter Standorte weit seltener genutzt wurden.
3.3 Eiablagehabitate
Die Eiablage erfolgte sowohl auf der Ober- als auch der Unterseite besonders sonnenexponierter Blätter der oben genannten Wirtspflanzen. Auffällig häufig wurden dabei waagerecht zum Boden wachsende Äste besetzt.
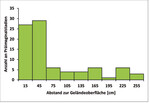
In den folgenden Untersuchungen wurden ausschließlich Funde der ersten Generation berücksichtigt. Betrachtet man den Abstand der Präimaginalstadien zur Geländeoberfläche, so fällt eine Bevorzugung bodennaher Blätter auf (Abb. 11).
65 % der gefundenen Präimaginalstadien liegen im Bereich zwischen Null und 60 cm über der Geländeoberfläche, wobei die Klasse „30 bis unter 60 cm“ die größte Häufigkeitsdichte aufweist. Die Spannweite der Funde reicht von 9 bis 267 cm. Das arithmetische Mittel, das dem Erwartungswert entspricht, beträgt 73,5 cm, während der Median bei 40,5 cm liegt. Da der Median kleiner als der Erwartungswert ist, handelt es sich hierbei um eine linkssteile Verteilung.
3.4 Phänologie
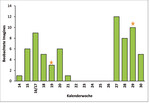
Während der Begehungen (sowohl innerhalb als auch außerhalb der Transekte) konnten insgesamt 66 Imagines des Segelfalters beobachtet werden. Die erste Beobachtung eines sich sonnenden Exemplars gelang am 03. April (KW 14).
Wie aus Abb. 12 hervorgeht, hatte die Flugzeit der ersten Generation des Segelfalters zum Untersuchungsbeginn Anfang April bereits begonnen. Sie fand Ende April einen vorläufigen Höhepunkt und endete Ende Mai. Die Eiablage dieser ersten Generation begann noch in der ersten Maihälfte.
Erste Falter der zweiten Generation wurden Anfang Juli beobachtet, auch gegen Ende der Untersuchungen Ende Juli waren weiterhin einige Imagines aktiv. Die Eiablage der zweiten Generation begann Mitte Juli.
Der früheste Eifund gelang am 10.05. 2017 und der früheste Raupenfund stammt vom 16.05.2017. Am 18.07.2017 konnte der erste Segelfalter der zweiten Generation bei der Eiablage in über 2 m Höhe beobachtet werden und am 28.07.2017 wurde die erste L1-Raupe der zweiten Generation aufgefunden.
Balzende Segelfalter konnten sowohl über den Silikatschutthalden als auch auf dem Magerrasen des Teilgebietes Frankenthal beobachtet werden. Auch Beobachtungen von Segelfaltern auf der Sitzwarte in einer Baumkrone gelangen hier regelmäßig. Im Falle des Magerrasens überschneiden sich Reproduktionsort und Balzareal.
4 Diskussion
4.1 Larvalhabitat
Das Larvalhabitat des Segelfalters ist im Untersuchungsgebiet auf besonders sonnen- und wärmeexponierte Mikrohabitate begrenzt. Die Fundorte unterstreichen die herausragende Bedeutung von sonnenexponierten Trockenmauern ebenso wie die nicht zu vernachlässigende Stellung von offenen, vollbesonnten und lückigen Magerrasen (vgl.Kinkleret al. 1991,Leopold2001,Steineret al. 2007). Auf den Magerrasen wurden zwar weniger Präimaginalstadien gefunden, allerdings ist dieser Biotoptyp im Untersuchungsgebiet auch deutlich kleinflächiger vorzufinden.
Untersuchungen vonSteineret al. (2007) haben gezeigt, dass die Temperatur über offenem, steinigem Boden in Südwestexposition sowohl tagsüber als auch nachts deutlich über der Temperatur über bewachsenem Boden auf einem Nordhang liegt. Nachts befinden sich die Temperaturen über einer Schotterstelle kontinuierlich 0,5 bis 1 °C über der Temperatur eines Magerrasens, während die Temperatur über beiden Flächen tagsüber vergleichbar ist. Die tagsüber durch Sonneneinstrahlung aufgenommene Wärme wird von den Steinen teils reflektiert und teils gespeichert und dann nachts abgestrahlt. Das fast ausschließliche Vorkommen von Präimaginalstadien des Segelfalters über offenem und steinigem Boden zeigt, dass dieser Untergrund ein günstiges Kleinklima für das Larvalhabitat des Segelfalters erzeugt. Dies unterstreicht die besondere Wärmebedürftigkeit dieser xerothermophilen Art.
Aufgrund der spezifischen Standortansprüche des Segelfalters gibt es auch eine typische Begleitfauna, die häufig gemeinsam mit dem Segelfalter vorkommt. Dazu zählen beispielsweise Zippammer, Neuntöter, Mauereidechse, Schlingnatter, Kleiner Schlehenzipfelfalter, Kreuzdorn-Zipfelfalter und Schmetterlingshaft (Kinkleret al. 1991). Bis auf die Schlingnatter und den Schmetterlingshaft konnten sämtliche genannten Arten im Untersuchungsgebiet nachgewiesen werden.
Stark verbuschte Bereiche konnten nur am Rand nach Präimaginalstadien untersucht werden. Es bleibt daher unklar, ob die sonnenexponierten Spitzen solcher Büsche auch zur Eiablage genutzt werden. Bei der Untersuchung des ebenfalls wärmeliebenden Kreuzdorn-Zipfelfalters ( Satyrium spini ) habenLoeffleret al. (2013) erarbeitet, dass höhere Standorte vor allem dann genutzt werden, wenn die Wirtspflanze auf einem Nordhang steht oder wenn die mikroklimatischen Verhältnisse beispielsweise durch eine geschützte Lage mit guter Wärmeentwicklung geprägt sind. Eine gute Wärmeentwicklung auf höheren Standorten ist vor allem bei steilen Südhängen gegeben, was die Funde in über zwei Metern Höhe in der sonnenexponierten Krone von Steinweichsel-Büschen und -Bäumen erklärt (Abb. 7). Aufgrund des durchschnittlich geringeren Wärmeangebots ist jedoch eher von einer Meidung stark verbuschter Bereiche auf weniger steilem Gelände auszugehen.
4.2 Raupennahrungspflanzen
Den Literaturangaben zufolge nutzt der Segelfalter eine große Zahl von Wirtspflanzen. Im Wesentlichen sind dies verschiedene Rosengewächse mit regional unterschiedlichen Präferenzen. Für Bayern und Baden-Württemberg gilt die Schlehe ( Prunus spinosa ) als mit Abstand wichtigste Wirtspflanze, an der gut 90 % der Präimaginalstadien gefunden wurden (Messlinger&Bolz2013,Steineret al. 2007). Darüber hinaus werden von diesen Autoren auch Funde an Stein-Weichsel ( Prunus mahaleb ), Echter Felsenbirne ( Amelanchier ovalis ), Vogelkirsche ( Sorbus aucuparia ), Zweigriffligem Weißdorn ( Crataegus laevigata ) und verschiedenen Kulturobstsorten beschrieben. Für Sachsen-Anhalt hatLeopold(2001) Schlehe und Felsenkirsche als wichtigste Fraßpflanzen ermittelt. In Rheinland-Pfalz gilt die Weichselkirsche ( Prunus mahaleb ) mit 85 % der Präimaginalfunde als wichtigste Wirtspflanze, gefolgt von Schlehe ( Prunus spinosa ), Wildkirsche ( Cerasus avium ) und Sauerkirsche ( Cerasus vulgaris ) (Kinkleret al. 1991).
In dieser Arbeit gelangen lediglich an Steinweichsel ( Prunus mahaleb ) und Schlehe ( Prunus spinosa ) Funde von Präimaginalstadien, wobei sich für das hessische Untersuchungsgebiet, ähnlich wie in Rheinland-Pfalz, eine deutliche regionale Bevorzugung der Steinweichsel zeigte. Aufgrund der Funde ist es jedoch nicht möglich, eine exakte Prozentzahl anzugeben, da insgesamt weniger als 100 Eier und Raupen gefunden wurden.
NachSteineret al. (2007) wurde in den meisten Fällen ein einzelnes Präimaginalstadium pro Wirtspflanze gefunden, wobei vor allem klimatisch günstig gelegene Pflanzen bis zu elf Präimaginalstadien beherbergen können.
Diese Tendenz konnte trotz der vergleichsweise wenigen Funde auch bei den Untersuchungen für diese Arbeit gezeigt werden. Ob ein Weibchen hintereinander mehrere Eier an dieselben Blätter heftet, ist jedoch unklar. Anhand von Abb. 9 kann dies zumindest nicht ausgeschlossen werden, da die Eier im gleichen, sehr frischen Stadium vorlagen.
4.3 Eiablagehabitate
Die vergleichsweise geringe Anzahl an Funden von Präimaginalstadien (86) ist zum einen der räumlichen Ausdehnung des Untersuchungsgebiets geschuldet, da Segelfalter meist nur in geringer Populationsdichte über große Gebiete verstreut auftreten (Messlinger & Bolz2013). Zum anderen liegt dies auch an der Geländestruktur. Im Untersuchungsgebiet verbreitete stark verbuschte Bereiche gestalteten das Auffinden solcher Stadien, falls sie dort überhaupt vorhanden waren, schwierig. Als weiterer Grund ist die Anzahl der Suchdurchgänge anzuführen. An insgesamt sechs Tagen im Mai wurden Präimaginalstadien des Segelfalters gesucht. Mit dem Übersehen einiger Eier ist daher zu rechnen. Insgesamt lässt sich also festhalten, dass die Anzahl von 86 Präimaginalstadien innerhalb des Untersuchungsgebiets eine absolute Mindestanzahl ist. Die tatsächliche Anzahl ist deutlich höher einzuschätzen.
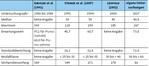
Die linkssteile Verteilung der Eier und Raupen über dem Boden könnte zum Teil auch dadurch erklärt werden, dass Eier und Raupen in niedriger Höhe leichter zu finden sind als in größeren Höhen. Dennoch sind die erhobenen Daten durchaus plausibel und trotz des relativ geringen Stichprobenumfangs mit den Angaben in der Literatur vergleichbar (Tab. 1).
Die Bevorzugung eher bodennaher Blätter zur Eiablage ist sicherlich ebenfalls der besonderen Wärmebedürftigkeit der Eier und Raupen des Segelfalters geschuldet (s.o.). Inwieweit der Klimawandel mit seinen steigenden Temperaturen Einfluss auf die Eiablagehöhe im Laufe der Zeit hat, kann anhand der vorliegenden Daten nicht eindeutig geklärt werden.
Bei der Eiablage der zweiten Segelfalter-Generation des Jahres sind aufgrund der höheren Umgebungstemperatur zum Zeitpunkt der Eiablage durchaus höhere Eiablagehabitate denkbar. So konnte am 18.07. die Eiablage eines Segelfalters auf einer Steinweichsel in über 2 m Höhe am Rand einer verbuschten Fläche beobachtet werden. Ende Mai wurde der gleiche Strauch bereits auf Präimaginalstadien der ersten Generation untersucht, wobei jedoch kein Fund verzeichnet werden konnte. Auch im Vergleich der Eiablagestandorte von der ersten zur zweiten Segelfalter-Generation besteht daher weiterer Untersuchungsbedarf.
4.4 Phänologie
In dieser Arbeit konnte für das Untersuchungsgebiet eine Verschiebung der Phänologie des Segelfalters gegenüber den Angaben vonKinkleret al. (1991) festgestellt werden. Der erste Falter konnte fast zwei Wochen früher und das erste Ei, die erste Raupe und der erste Falter der zweiten Generation ca. eine Woche früher beobachtet werden, während die Eiablage der zweiten Generation im gewöhnlichen Bereich lag. Eine erste Raupe der zweiten Generation wurde wiederum wenige Tage früher als erwartet beobachtet.
Diese Verfrühung kann aufgrund der räumlichen Nähe und standörtlichen Vergleichbarkeit des Untersuchungsgebiets zum Bundesland Rheinland-Pfalz nicht durch unterschiedliche Voraussetzungen erklärt werden. Vielmehr scheint das warme, trockene und sonnige Frühjahr verantwortlich zu sein. Besonders der außergewöhnlich warme März scheint den Schlupf der Segelfalter aus ihrer Puppe stark beschleunigt zu haben, was starke Aktivitäten Mitte April zur Folge hatte.
Welchen Einfluss der Klimawandel auf die Verfrühung der Entwicklung des Segelfalters hat, müssen langfristig angelegte Untersuchungen zeigen. Es ist jedoch davon auszugehen, dass deren Entwicklung weiter verfrüht und die Ausprägung der zweiten Generation begünstigt wird, vergleichbar mit dem bereits festgestellten früheren Pflanzenaustrieb und der Verlängerung der Vegetationsdauer (DWD2017).
Da die Flugzeit der Imagines des Segelfalters mit Untersuchungsbeginn unerwarteterweise schon begonnen hatte und mit Ende der Untersuchungen noch nicht beendet war, kann keine exakte Aussage über die Ausprägung der jeweiligen Generationen getroffen werden. Fest steht jedoch, dass im Untersuchungsgebiet eine durchaus ausgeprägte zweite Generation vorzufinden ist. Dass von dieser Generation auch Eier und Raupen gefunden wurden, unterstreicht das günstige Ausgangsklima, das im Untersuchungsgebiet durch die Trockenmauern und Magerrasen auf steilen Hängen erzeugt wird. NachKinkleret al. (1991) tritt die zweite Generation in Rheinland-Pfalz nur in warmen Jahren auf und Eier- oder Raupenfunde dieser Generation sind nur an besonders wärmebegünstigten Lokalitäten zu beobachten. Das Untersuchungsgebiet weist damit ideale klimatische Ausgangsbedingungen für den Segelfalter auf und eignet sich daher besonders gut zum Erhalt dieser bundesweit stark gefährdeten Art.
In den warmen Jahren 1986 und 1988 wies die zweite Generation der rheinland-pfälzischen Segelfalter eine Individuenzahl von etwa 15 % der ersten Generation auf (Kinkleret al. 1991). Obwohl für das Untersuchungsgebiet keine prozentuale Aussage über die Individuenzahl der zweiten Generation getroffen werden kann, erscheinen 15 % für das Jahr 2017 relativ niedrig. Für den Untersuchungszeitraum stehen 35 beobachtete Imagines der zweiten Generation 31 beobachteten Imagines der ersten Generation gegenüber. Die Erfassungsintensität blieb über den gesamten Zeitraum gleich, jedoch ist zu beachten, dass die vermehrte Erfassung von Segelfaltern ab Anfang Juli auch der vermehrten Verfügbarkeit von Nektarpflanzen am Boden zuzurechnen ist. Falter der ersten Generation wurden deutlich seltener beim Saugen an einer Blüte beobachtet und hielten sich daher seltener nah am Boden auf. Daraus könnte eine etwas niedrigere Erfassungsquote der ersten Generation resultieren.
5 Konsequenzen für die Pflege
Zur Förderung des Segelfalters sollten verbuschte Magerrasen, Trockenmauern und Lesesteinriegel freigestellt und beispielsweise durch mosaikartige Schaf- und Ziegenbeweidung langfristig offen gehalten werden. Bei einer Beweidung ist darauf zu achten, dass zur Reproduktionszeit des Segelfalters (Anfang Mai bis Mitte August) nicht alle potenziellen Larvalhabitate beweidet werden, da sonst viele Eier und Raupen der bevorzugten bodennahen Standorte mitgefressen werden könnten (Steineret al. 2007).
Zur Pflege ist es zusätzlich hilfreich, stark verbuschte Bereiche alternierend „auf den Stock“ zu setzen, um so stetig neue offene Strukturen zu schaffen. Empfohlen wird das alternierende Zurückschneiden eines Viertels der Gebüsche alle vier Jahre. Lediglich einzelne niedrigwüchsige Büsche und Sträucher mit Krüppelwuchs sollten langfristig erhalten bleiben. Darüber hinaus gilt die Wiederaufnahme der ehemals weit verbreiteten Niederwaldwirtschaft als ein Ansatz zur Schaffung neuer Segelfalterhabitate(vgl.Fartmann&Timmermann2006,Leopold2001,Loeffleret al. 2013,Steineret al. 2007).
Die Grenzen der Weinbergsflächen sind bei der Ausbringung von Pflanzenschutzmitteln streng einzuhalten, da attraktive Larvalhabitate oft in direktem Umfeld der Weinreben zu finden sind (Abb. 3 und Abb. 4). Auf die Ausbringung mittels Hubschrauber sollte verzichtet werden, da es so zur unkontrollierbaren Verdriftung in Larvalhabitate des Segelfalters kommt. Gelangen dessen Eier oder Raupen mit Insektiziden, Akariziden oder sogar bienenungefährlichen Insektiziden in Kontakt, werden sie direkt abgetötet (Kinkleret al. 1991).
Unbedingt zu unterlassen sind das Mulchen oder Zurückschneiden sämtlicher Gehölze, insbesondere in kleinflächigen Biotopen, da diese Maßnahmen zum Erlöschen einer lokalen Population führen können(vgl.Loeffleret al. 2013).
Die häufig vorgebrachten Bedenken, dass solche Gehölzentfernungen gefährdeten Heckenbrütern, wie dem Neuntöter ( Lanius collurio ) schaden, da wichtige Brutplätze und Ansitzwarten zerstört würden, wurde durch eine Studie vonStoosset al. (2017) entkräftet. Ganz im Gegenteil steigt die Bestandsdichte des Neuntöters, wenn flächig verbuschte Bereiche freigestellt werden. Bestandslimitierend für diese Art ist vielmehr das Nahrungsangebot auf offenen kurzrasigen Magerrasen und nicht das Angebot an Brutplätzen oder Ansitzwarten. Einzelne kleingehaltene Hecken und Gebüsche reichen der Art als Brutplatz und Ansitzwarten völlig aus.
Dank
Für die Bereitstellung ihrer Liegenschaften sei der NABU-Stiftung Hessisches Naturerbe und deren Vorsitzenden Hartmut Mai besonders gedankt.
Literatur
Deutscher Wetterdienst (2017): Klimawandel – ein Überblick. Offenbach. www.dwd.de/DE/klimaumwelt/klimawandel/ueberblick/ueberblick _node.html. Zugriff: 02.08.2017.
Fartmann, T.(2017): Überleben in fragmentierten Landschaften. Naturschutz und Landschaftsplanung 49 (9), 277-282.
–,Hermann, G.(2006): Larvalökologie von Tagfaltern und Widderchen in Mitteleuropa – von den Anfängen bis heute. Abh. Westf. Mus. Naturkde. 68 (3/4), 11-57.
–,Timmermann, K.(2006): Where to find the eggs and how to manage the breeding sites of the Brown Hairstreak (Thecla betulae (Linnaeus, 1758)) in Central Europe? Nota lepidopterologica 29 (1/2), 125-134.
HLNUG – Hessisches Landesamt für Naturschutz, Umwelt und Geologie (2016): Umweltatlas Hessen. atlas.umwelt.hessen.de/servlet/Frame/atlas/allg_dat/inhalt.htm, Zugriff: 24. 02.2017.
Kinkler, H., Bettag, E., Hasselbach, W., Hürter, H.A., Kinkler, R., Knoblauch, J. (1991): Der Segelfalter (Iphiclides podalirius L.) in Rheinland-Pfalz – ein Artenschutzprojekt. Beiträge Landespflege Rheinland-Pfalz 14, 7-94.
Kühn, E.,Musche, M.,Harpke, A.,Feldmann, R.,Metzler, B.,Wiemers, M.,Hirneisen, N.,Settele, J. (2014): Tagfalter-Monitoring Deutschland – Anleitung. www.ufz.de/export/data/ 6/125122_OEDIPPUS_Band27.pdf. Zugriff: 25. 02.2017.
Leopold, P.(2001): Schmetterlingszönosen ausgewählter Kalk-Magerrasen im Saale-Unstrut-Gebiet (Sachsen-Anhalt) unter besonderer Berücksichtigung der Habitate des Segelfalters und der Berghexe. Unveröff. Dipl.-Arb., Münster, 78 S.
Loeffler, F.,Stuhldreher, G.,Fartmann, T. (2013): How much care does a shrub-feeding hairstreak butterfly,Satyrium spini (Lepidoptera: Lycaenidae), need in calcareous grasslands? European Journal of Entomology 110 (1), 145-152.
Messlinger, U.,Bolz, R.(2013): SegelfalterIphiclides podalirius (Linnaeus, 1758). In: Bräu, M., Bolz, R., Kolbeck, H., Nummer, A., Voith, J., Wolf, W., Tagfalter in Bayern, Ulmer, Stuttgart, 129-131.
Poschlod, P.(2015): Geschichte der Kulturlandschaft, Ulmer, Stuttgart, 320 S.
Settele, J., Steiner, R., Reinhardt, R., Feldmann, R., Hermann, G. (2015): Schmetterlinge – die Tagfalter Deutschlands. Ulmer, Stuttgart, 3. Aufl., 256 S.
Steiner, R. Hermann, G., Settele, J. (2007): Ökologie einer aussterbenden Population des SegelfaltersIphiclides podalirius (Linnaeus, 1758). Invertebrate Ecology and Conservation Monographs 1. Pensoft Publ., Sofia, Bulgarien, 171 S.
Stooss, T., Straub, F., Mayer, J. (2017): Gebüschbrüter profitiert von Gehölzentfernung – Einfluss intensivierter Beweidung und Teilrodung auf die Bestandsdichte des Neuntöters (Lanius collurio ). Naturschutz und Landschaftsplanung 49 (7), 213-220.
Fazit für die Praxis
- • Durch eine Freistellung und kontinuierliche Offenhaltung von Magerrasen, Trockenmauern und Lesesteinriegeln können besonders wertvolle Lebensräume für xerothermophile Tagfalter, Reptilien und Vögel erhalten werden. Die Wiederaufnahme der Niederwaldwirtschaft kann zudem neue trocken-warme Lebensräume schaffen.
- • Das Aufkommen vereinzelter Sträucher soll zugelassen werden, diese müssen aber regelmäßig und alternierend „auf den Stock“ gesetzt werden. Dies fördert niedrigwüchsige Büsche und Sträucher mit Krüppelwuchs, die für die Eiablage des Segelfalters ideal sind.
- • Eine mosaikartige Beweidung stellt auf ausreichend großen Flächen eine geeignete Pflegemaßnahme dar. In stark verbuschten Bereichen ist zusätzlich ein alternierender Rückschnitt der Gehölze empfehlenswert.
- • Die Grenzen der Weinbergsflächen sind bei der Ausbringung von Pflanzenschutzmitteln streng einzuhalten.
Kontakt
B. Sc. Nico Flügel studiert seit 2013 mit Schwerpunkt Naturschutz und Freilandökologie an der Technischen Hochschule Bingen. Sein Bachelor-Studium Umweltschutz schloss er 2017 ab und studiert seitdem den Master Landwirtschaft und Umwelt. Dort arbeitet er in der Forschergruppe „Biodiversität in der Kulturlandschaft“ mit. Seit 2016 studienbegleitende Tätigkeit als freiberuflicher avifaunistischer Kartierer.
Prof. Dr. Michael Rademacher ist seit September 2015 als Professor für Biodiversität und Ökologie im Studiengang Umweltschutz der Technischen Hochschule Bingen tätig. Nach seinem Studium der Geobotanik und Zoologie in Freiburg i. Br. hat er mehrere Jahre als freiberuflicher Gutachter gearbeitet und dann 15 Jahre im Unternehmen HeidelbergCement das Ressort Biodiversität und Naturschutz geleitet.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen








Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.