Management des Goldenen Scheckenfalters
Abstracts
Der Goldene Scheckenfalter ( Euphydryas aurinia ) gehört in Mitteleuropa aufgrund der großflächigen landwirtschaftlichen Intensivierung zu den am stärksten gefährdeten Tagfalterarten. Unsicherheiten bestehen vor allem hinsichtlich der erforderlichen Maßnhamen mit dem Ziel eines effizienten Schutzes der Art. So sind die Auswirkungen der Mahd auf die Überlebensraten der Larven noch ungeklärt.
Untersuchungen in Niedermoorgebieten des württembergischen Allgäus belegen, dass rein durch den Mahdvorgang keine Beeinträchtigung der Larven stattfindet. Vielmehr sind Faktoren wie Metapopulationsverbund, Habitatstruktur, Witterung und Parasitoidendruck entscheidend für eine langfristige Persistenz der Art.
Schutzmaßnahmen müssen daher einen möglichst engen Verbund zahlreicher Habitate mit geeigneter Vegetationsstruktur anstreben. Von der gängigen Praxis der Naturschutzpflege (späte Schnittzeitpunkte, große Schnitthöhe, Belassen größerer Brachebereiche) muss zugunsten einer mageren und niedrigwüchsigen Vegetationsstruktur zur Förderung des Goldenen Scheckenfalters und weiterer gefährdeter Insektenarten abgewichen werden.
Management of the marsh fritillary – Survey in fen meadows of the Allgäu region
Due to agricultural intensification the marsh fritillary ( Euphydryas aurinia ) has become one of the most endangered butterfly species throughout Central Europe. There is a lack of knowledge about suitable conservation measures for the species in general and about the impact of mowing on larval survival in particular. Our study in fen meadows in the Allgäu region, located in the southeastern part of the German federal state of Baden-Württemberg, clearly showed that the larval stages are not negatively affected by mowing. Habitat networks (due to the metapopulation structure), habitat structure, weather conditions, and parasitoids are more likely to be the main drivers of long-term persistence of E. aurinia . Therefore, conservation measures have to incorporate a dense network of habitat patches with suitable vegetation structure. In contrast to previously conducted habitat management practices for the species (late mowing date, high mowing height, leaving of uncut parts), habitat management for the Marsh Fritillary and many other threatened species should aim at creating low-nutrient and low-growing vegetation within the habitat patches.
- Veröffentlicht am

1 Einleitung
1.1 Allgemeines
Der Goldene Scheckenfalter ( Euphydryas aurinia ) (Rottemburg, 1775) gehört in Mitteleuropa zu den am stärksten gefährdeten Tagfalterarten. Weite Bereiche seines ehemaligen Areals musste die Art vor allem aufgrund landwirtschaftlicher Intensivierung aufgeben (Ebert & Rennwald1991,Fischer1997,Thoss2004). Die europäische Staatengemeinschaft hat sich deshalb mit der Aufnahme der Art in den Anhang II der Fauna-Flora-Habitat-Richtlinie (FFH/92/43/EEC) verpflichtet, Maßnahmen zur dauerhaften Existenzsicherung der Art zu ergreifen. Hierzu gehören die Ausweisung von FFH-Gebieten und die Erstellung von spezifischen Managementplänen (MaP), denen ein detailliertes Schutz- und Maßnahmenkonzept zugrunde liegt.
Der Goldene Scheckenfalter gilt deutschlandweit als stark gefährdet (Reinhardt & Bolz2011), in Baden-Württemberg wird er als „Vom Aussterben bedroht“ eingestuft (Ebertet al. 2005). Deshalb wurden in Baden-Württemberg alle bekannten Populationen in das Arten- und Biotopschutzprogramm des Landes aufgenommen. Im Rahmen der Umsetzung des Artenschutzprogramms werden für jedes einzelne Vorkommen spezifische Schutz- und Pflegemaßnahmen erarbeitet, um einen möglichst effizienten Schutz der Art zu gewährleisten.
Während die Autökologie des Goldenen Scheckenfalters mittlerweile gut erforscht und die Ansprüche der Art an ihre Habitate gut verstanden sind (z.B.Antheset al. 2003b), bestehen immer noch Unsicherheiten hinsichtlich eines effizienten Managements der Art (Antheset al. 2003a,Bräu & Nunner2003,Hulaet al. 2004). Vor allem der Einfluss der Mahd auf die in Gespinsten gemeinschaftlich (gregär) lebenden Raupen wurde bisher nicht im Detail untersucht (Antheset al. 2003b,Anthes & Nunner2006). Vorhandenes Wissen beschränkt sich meist auf einzelne Zufallsbeobachtungen oder auf theoretische Schlussfolgerungen ohne direkten Beleg (Bräu & Nunner2003), weshalb Forschungsbedarf besteht.
Konkret stellt sich die Frage, ob und in welchem Umfang Larven oder ganze Larvenkollektive durch den Mahdvorgang entweder durch direkte Einwirkungen (z.B. Zerschneiden, Zerquetschen) oder durch indirekte Einflüsse (z.B. Entfernen der Raupengespinste mit dem Mähgut) beeinträchtigt werden. Dieser Frage wurde im Sommer 2015 im Rahmen einer Abschlussarbeit nachgegangen.
1.2 Autökologie des Goldenen Scheckenfalters
Der Goldene Scheckenfalter besiedelt ein sehr breites Habitatspektrum, das von trocken bis nass reicht (z.B.Ebert & Rennwald1991,Nunneret al. 2013). Aufgrund des Wegfalls mesophiler Standorte durch flächendeckende Nutzungsintensivierung werden heutzutage die Extreme (xerotherme Magerrasenkomplexe und streugenutzte Niedermoore) besiedelt. Gemein ist diesen Lebensräumen eine sehr extensive Nutzung, eine geringe Nährstoffverfügbarkeit und oft eine eher niedrigwüchsige Vegetation mit lückigem Obergrashorizont (Antheset al. 2003b,Konvickaet al. 2003,Nunneret al. 2013). In Feuchtlebensräumen dient der Teufelsabbiss ( Succisa pratensis ) als wichtigste Wirtspflanze. Seltener werden vor allem nach der Überwinterung verschiedene andere Pflanzen (z.B. Enziane aus der Gattung Gentiana ) als Nahrung akzeptiert (Übersichten beiAntheset al. 2003a undAnthes & Nunner2006). Bevorzugt werden große, kräftige, für die Weibchen frei zugängliche Pflanzen, während kümmerliche, kleinblättrige Pflanzen oder solche in dicht- und hochwüchsiger Vegetation weitgehend gemieden werden (z.B.Antheset al. 2003b,Konvickaet al. 2003,Thoss2004).
Die Weibchen der in Mitteleuropa in Normaljahren von Anfang Mai bis Anfang Juli fliegenden Falter legen ihre Eier (durchschnittlich 250) geklumpt an die Unterseite der Grundrosettenblätter ab. Die Raupen schlüpfen 18 bis 39 (im Durchschnitt 30) Tage später und leben gesellig in einem Gespinst, das ihnen einen gewissen Schutz vor Parasitoiden (Brackwespen der Gattung Cotesia ) und anderen Fressfeinden bietet (Anthes & Nunner2006,Nunneret al. 2013). Bis in den August hinein wachsen Larven und Gespinste heran, bis die Fraßgespinste meist die komplette Pflanze mit Ausnahme des apikalen Stielbereichs und der Blüte umfassen. Dann wandern die Larven wieder langsam herab, stellen die Nahrungsaufnahme weitgehend ein und legen bodennah ein etwa golfballgroßes, dicht umwobenes Überwinterungsgespinst an. Je nach Zeitpunkt der Mahd und Witterungsverlauf sind die Raupen während der Mahd noch fraßaktiv oder befinden sich bereits im Überwinterungsgespinst. Nach der Überwinterung lockert sich die gregäre Lebensweise der Larven allmählich, sie vereinzeln sich und wachsen rasch heran, um sich im Frühjahr zu verpuppen (z.B.Nunneret al. 2013).
Der Goldene Scheckenfalter bildet in mitteleuropäischen Kulturlandschaften heute fast ausnahmslos Metapopulationen aus und ist dabei auf eine räumliche Verbundsituation der Habitate angewiesen (z.B.Antheset al. 2003a,Hulaet al. 2004). Nur hierdurch ist die durch enorme Populationsschwankungen charakterisierte Art in der Lage, das Erlöschen einzelner Lokalpopulationen – etwa durch erhöhten Parasitoidendruck oder ungünstige Witterungsverhältnisse – zu kompensieren und verwaiste Habitate wiederzubesiedeln (Ford & Ford1930,Porter1983,Klapwijk & Lewis2014).
1.3 Verbreitung in Baden-Württemberg und im Untersuchungsgebiet
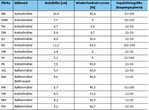
In Baden-Württemberg existieren nur noch Reliktpopulationen der hier einst weit verbreiteten Art. Neben einem isolierten Restvorkommen am Westrand des Nordschwarzwaldes bestehen individuenreichere (Meta-)Populationen am Kaiserstuhl, im nördlichen Oberschwaben und vor allem im württembergischen Allgäu. Hier kommt der Goldene Scheckenfalter in einem etwa 500 km² großen Gebiet in etwa 70 miteinander verknüpften Lokalpopulationen vor. Die Vorkommen sind meist klein, die Zahlen nachgewiesener Raupengespinste betragen an den meisten Fundorten zwischen zehn und 20, die größten Populationen erreichen etwa 500 Raupengespinste. Aus den bekannten Vorkommen wurden für die vorliegende Untersuchung die 15 größten ausgewählt.
1.4 Bearbeitete Fragestellungen
Um die Auswirkungen der Mahd auf die Raupengespinste des Goldenen Scheckenfalters zu klären, wurden im Rahmen einer Abschlussarbeit (Dittrich2016) folgende Fragestellungen bearbeitet:
- Wie wirken sich unterschiedliche Mahdhöhen auf die Überlebensrate der Larven aus?
- Welchen Einfluss zeigen unterschiedliche Mähwerke auf die Überlebensrate der Larven?
- Wie wirken sich unterschiedliche Mahdzeitpunkte auf die Überlebensrate der Larven aus?
- Gibt es weitere Parameter, die die Überlebensrate der Larven beeinflussen?
2 Material und Methoden
Im Juli 2015 wurden in den Larvalhabitaten je nach Gebietsgröße und Gespinstdichte zwischen sieben und 30 Raupengespinste pro Untersuchungsgebiet markiert, wobei insgesamt 275 Raupengespinste erfasst wurden. Um die Standorte der Raupengespinste nach der Mahd wiederzufinden, wurden an der Basis jeder befallenen Pflanze mit Nägeln fixierte Magnete in den Boden eingelassen (Abb. 1). Die Gespinstfundorte wurden mittels GPS verortet und in einer Karte eingetragen.
An den Gespinststandorten wurden verschiedene Parameter erhoben, um die bevorzugte Struktur der Larvalhabitate bestimmen zu können. In Anlehnung anAntheset al. (2003a, b) wurde die horizontale Vegetationsstruktur in 5, 10, 20, 30 und 40 cm Höhe in 5-%-Schritten bestimmt sowie Höhe, Durchmesser und Anzahl der Grundrosettenblätter ermittelt. Auch Größe der Gespinste und Grad des Befalls der Pflanze wurden vermerkt.
Zum Zeitpunkt der Mahd – die je nach Standort zwischen Ende August und Ende Oktober stattfand – wurde für jede Fläche ein Termin mit dem pflegenden Landwirt vereinbart und die Mahd „live“ mitverfolgt. Bei der Kontrolle direkt nach der Mahd auf das Vorhandensein eines Gespinstes oder von Gespinstresten mit Hilfe eines Magnetsuchgerätes (Heliflux GA-72cD) wurden Larven und Gespinste auf ihren Zustand überprüft sowie das verwendete Mähwerk, die Mahdtechnik und die Mahdhöhe aufgenommen. Zudem wurde auch im benachbarten Mähgut nach verdrifteten Larven und Gespinsten gesucht. Weitere Arbeitsschritte (Zetten, Schwaden, Abtransport des Mähguts) konnten aus Zeitgründen nur stichprobenartig bezüglich eines möglichen negativen Einflusses auf die Larvalstadien überprüft werden.
3 Ergebnisse
3.1 Strukturparameter
Die Erhebung der Strukturparameter bestätigte die aus der Literatur (z.B.Antheset al. 2003b,Konvickaet al. 2003,Nunneret al. 2013) bereits bekannte Bevorzugung einer niedrigwüchsigen, von einem lückigen Obergrashorizont geprägten Vegetationsstruktur mit kräftigen Pflanzen des Teufelsabbiss auch für das württembergische Allgäu (vgl.Dittrich2016).
3.2 Wiederfundraten von Larven
Den 275 markierten Gespinsten konnten nach der Mahd noch 99 (36 %) Gespinste, die Larven enthielten, zugeordnet werden. An den restlichen 176 Pflanzen waren meist nur noch Gespinstreste erkennbar. In den 99 wiedergefundenen, mehr oder weniger intakten Gespinsten konnten ausschließlich lebende Larven nachgewiesen werden, unabhängig davon, ob die Gespinste von den Mähwerken teilweise erfasst wurden oder komplett abgetrennt im Mähgut zu finden waren (Abb. 2). Es konnte kein Nachweis von durch die Mähwerke in irgendeiner Form beeinträchtigter oder gar getöteter Larven erbracht werden (vgl.Dittrich2016).
Auf einer aufgrund fehlender Absprache bereits früher (Mitte August) gemähten Streuwiese konnten nach Mahd und Abtransport des Mähguts mehrere neu angelegte, kleine Raupengespinste gefunden werden.
Auf von der Mähraupe und von konventionellen Schleppern gemähten Flächen wurde zudem exemplarisch das Überfahren der Gespinste (n = 20) mittels Ketten und Reifen überprüft. In allen Fällen überstanden die Larven das Überfahren schadlos.
3.3 Mahdhöhe
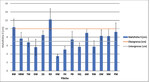
Die Mahdhöhe auf den Flächen schwankte zwischen durchschnittlich 3,4 und 12,2 cm (Abb. 3). Vertraglich ist aus Artenschutzgründen (v.a. Amphibienschutz) generell eine Schnitthöhe zwischen 7 und 10 cm vereinbart, in einigen Fällen wurde diese Vorgabe also unter- wie teilweise auch überschritten.
Die Wiederfundrate von Larven (p = 0,01) und Gespinsten (p = 0,03) war signifikant abhängig von der Mahdhöhe. Je tiefer gemäht wurde, desto geringer war die Wahrscheinlichkeit, am ursprünglichen Standort des Gespinstes noch Larven oder ganze Gespinste zu finden. Auch der Grad der Beschädigung der Gespinste stand in maßgeblichem Zusammenhang (p = 0,003) mit der Mahdhöhe. Je tiefer gemäht wurde, desto höher war der Grad der Beschädigung der Gespinste (vgl.Dittrich2016).
3.4 Mähwerke
Es konnte kein Zusammenhang zwischen der Art des verwendeten Mähwerks und den Wiederfundraten von Larven und Gespinsten sowie dem Grad der Beschädigung der Gespinste gefunden werden (vgl.Dittrich2016).
Tab. 1 fasst die wichtigsten Fakten zu den untersuchten Flächen zusammen. Allein zwischen der Mahdhöhe und der Wiederfundrate der Larven besteht ein bedeutender Zusammenhang, wohingegen für die Wiederfundrate der Larven in Bezug zum Mähwerk und für die Populationsgröße in Bezug zum Mähwerk oder zur Mahdhöhe keine Abhängigkeit ermittelt werden konnte.
4 Diskussion
Zu allererst muss betont werden, dass sich die Erkenntnisse ausschließlich auf Feuchtlebensräume anwenden lassen und keinesfalls auf Trockenstandorte übertragbar sind. Die Ansprüche des Goldenen Scheckenfalters an sein Larvalhabitat gleichen im württembergischen Allgäu denjenigen in anderen Regionen Deutschlands, z.B. in Sachsen oder im bayerischen Alpenvorland (Anthes2000, 2002;Bräu & Nunner2003,Thoss2004). Belegt werden bevorzugt kräftige, für die Weibchen gut zugängliche Pflanzen des Teufelsabbiss in niedrigwüchsiger Vegetation, welche in jährlich gemähten Flächen oder auch in jungen Brachen vorkommen.
Die größte Schwierigkeit in der Untersuchung des Einflusses der Mahd auf die Raupengespinste besteht darin, die Gespinste nach der Mahd wiederzufinden und eventuelle Verluste direkt nachzuweisen (vgl.Bräu & Nunner2003). Bisher lagen nur vereinzelte Beobachtungen von nach der Mahd neu gebildeten Überwinterungsgespinsten und sekundären Fraßgespinsten vor, die zumindest einen Hinweis darauf gaben, dass ein gewisser Anteil der Raupen die Mahd überlebt (Anthes & Nunner2006,Bräu & Nunner2003). Mithilfe der angewandten Markierungsmethode wurde nun erstmals der direkte Einfluss der Mahd auf die Raupengespinste untersucht. Die Wiederfundrate von 36 % der Raupengespinste zeigt, dass diese Methode bei großer Schnitthöhe erfolgreich, die Nachweiswahrscheinlichkeit jedoch mit geringer werdender Schnitthöhe deutlich reduziert war.
Da es aus Zeitgründen nicht möglich war, die Raupengespinste direkt vor der Mahd auf ihr Vorhandensein an den markierten Stellen zu überprüfen, ist von einer unbestimmten Anzahl zu diesem Zeitpunkt nicht mehr vorhandener Raupengespinste auszugehen. Wie Einzelbeobachtungen belegen, können die Larven z.B. aus Nahrungsmangel zu einer anderen Pflanze abgewandert oder durch Parasitoide ausgelöscht worden sein (vgl.Klapwijk & Lewis2014). Beispielsweise benötigen in Südbayern Jungraupengruppen vor der Diapause zwei bis drei Succisa -Pflanzen mittlerer Größe, um ihren Nahrungsbedarf zu decken (Anthes & Nunner2006). Daher wäre die Wiederfundrate von 36 % wahrscheinlich höher ausgefallen, wenn die Anzahl noch vorhandener Raupengespinste unmittelbar vor der Mahd überprüft worden wäre.
Die erhobenen Daten belegen eindeutig, dass bei geringeren Mahdhöhen deutlich weniger Raupengespinste nachgewiesen werden können. Liegt die Mahdhöhe unterhalb von 5 cm, werden die Gespinste fast zu 100 % von den Mähwerken erfasst, weshalb häufig daraus geschlossen wird, dass die nicht mehr gefundenen Larven den Mahdvorgang nicht überlebt haben (z.B.Quingeret al. 1995). Nach unseren Befunden ist aber davon auszugehen, dass sich die Larven zwar im Mähgut befanden, sie sich daraus aber teilweise im Verlauf der weiteren landwirtschaftlichen Arbeitsschritte (Zetten und Schwaden) wieder befreien können. Anschließend re-aggregieren sie sich zu kleineren Gruppen, die Sekundärgespinste anlegen (meist kleinere Überwinterungsgespinste). Hierfür sprechen zahlreiche Nachweise unversehrter E. aurinia -Larven im Mähgut, Funde neu angelegter Gespinste in bereits im August in niedriger Höhe gemähten Streuwiesen sowie Nachweise kleiner Raupengruppen im zeitigen Frühjahr direkt nach der Überwinterung in komplett gemähten Streuwiesen (vgl.Bräu & Nunner2003).
Auf vielen traditionell niedrig und komplett gemähten Streuwiesen existieren jährlich nachweisbare und individuenreiche Populationen des Goldenen Scheckenfalters, was ein weiteres wichtiges Indiz für die Unabhängigkeit der larvalen Überlebensrate von der Mahdhöhe ist. Beispielsweise werden auf der Streuwiese Fidelershof (FH) jährlich etwa 50 Raupengespinste und Imagines gezählt, obwohl dort traditionell jahreszeitlich früh (Ende August/Anfang September), tief und vollständig gemäht wird. Zudem existieren auf der Fläche mittlerweile weiträumig isolierte Vorkommen der anspruchsvollen Streuwiesenarten Heilziest-Dickkopffalter ( Carcharodus flocciferus ) und Westlicher Scheckenfalter ( Melitaea parthenoides ) als weitere Indikatoren für die hohe Wertigkeit des Habitats. Ähnliche Beobachtungen liegen aus dem angrenzenden bayerischen Alpenvorland vor, woBräu & Nunner(2003) auf einer jährlich sehr tief und vollständig gemähten Streuwiese hohe Gespinstdichten (364 Raupengespinste auf 2,16 ha) nachweisen konnten.
Die gewonnenen Daten konnten weiterhin keinen Beleg für etwaige Einflüsse der Mähtechnik auf die Überlebensrate der Larven liefern. Die in der Literatur häufig behaupteten letalen Effekte von Trommel- und Scheibenmähwerken (vgl.Detzel1985,Humbertet al. 2010,Oppermann1987) konnten im Rahmen dieser Studie nicht belegt werden. Weder fand durch die Verwendung von Scheibenmähwerken ein übermäßiges Zerkleinern der Vegetation statt – die Halmlänge betrug nach der Mahd ca. 50 cm – noch wurden die Larven von den gegenläufigen Messern beeinträchtigt. Da die Larven zum Zeitpunkt der Mahd eine Länge von ca. 0,5 cm besitzen und die Klingenbreite der Messer ebenfalls ähnlich groß ist, ist die Gefahr des Zerquetschens oder Zerschneidens für die Raupen äußerst gering. Sie sind einfach zu klein, um von den Messern erfasst zu werden. Größere Wirbellose und kleinere Wirbeltiere können allerdings von den Mähwerken erfasst und getötet werden, wie eigene Beobachtungen (z.B. Grünes Heupferd – Tettigonia viridissima , Warzenbeißer – Decticus verrucivorus oder Larven des Brombeerspinners – Macrothylacia rubi, Grasfrosch – Rana temporaria ) belegen. Doch auch bei diesen Arten ist zu bezweifeln, dass mahdbedingte Individuenverluste Populationsrelevanz entfalten. Man denke nur an massive Individuenverluste dieser Arten durch Prädatoren unmittelbar nach der Mahd (Greife, Störche, Reiher, Krähen etc.), die von der Mähtechnik gänzlich unabhängig sind.
Auch das Überfahren der Gespinste durch die Reifen der Schlepper und Mähraupen kann in Moorgebieten des Alpenvorlandes auf Basis exemplarischer Beobachtungen als negativ wirksamer Faktor weitgehend ausgeschlossen werden. In 20 konkreten Fällen wurde nachgewiesen, dass die Larven ein Überfahren aufgrund des geringen Bodendrucks durch die breiten Reifen, des groben Profils der Reifen und der weichen Niedermoorböden schadlos überstehen.
Ein negativer Einfluss des Mahdzeitpunktes auf die Überlebensrate der Larven scheint naheliegend. Denn wenn zu einem vergleichsweise frühen Zeitpunkt (Ende August/Anfang September) gemäht wird, befinden sich viele Larven noch in der fressaktiven Phase, die Gespinste sind dann noch entsprechend hoch in der Vegetation verankert. In der Tat ließ sich auch durch Beobachtungen bestätigen, dass bei früher Mahd zahlreiche Gespinste direkt von den Mähwerken erfasst werden. Etwas überraschend zeigte sich aber, dass zumindest Teile des Raupenbestandes zu dieser Jahreszeit noch aktiv genug sind, um das Mähgut noch vor dem Abtransport erfolgreich zu verlassen und neue (Überwinterungs-)Gespinste anzulegen (s.o.).
Wird der Mahdzeitpunkt weiter nach hinten in die zweite Septemberhälfte oder gar in den Oktober hinein verlagert, befinden sich die Larven überwiegend bodennah in Wintergespinsten, welche wenig bis nicht beeinträchtigt werden, sofern eine Mahdhöhe von über 5 cm eingehalten wird. Findet allerdings eine sehr tiefe Mahd statt, werden die Überwinterungsgespinste erfasst. Aufgrund der zu dieser Zeit häufig bereits kühl-feuchten Witterungsverhältnisse und der einsetzenden Inaktivität der überwinterungsbereiten Larven ist ihre Mobilität nun deutlich eingeschränkt. Insoweit dürften zu diesem Zeitpunkt im Mähgut befindliche Raupen kaum noch in der Lage sein, aus dem Mähgut zu entkommen, um sich neu zu formieren. Eine höhere mahdbedingte Mortalität wäre in diesem Fall zu erwarten, bliebe jedoch durch eingehendere Beobachtungen zu prüfen. Allerdings wäre auch eine Überwinterung einzelner Raupen oder sehr kleiner Raupenkollektive in zusammengerollten Falllaubblättern oder in der Moos- und Streuschicht grundsätzlich vorstellbar, worauf entsprechende Einzelbeobachtungen in einer E. aurinia -Population im Nordschwarzwald hindeuten (S.Hafner, in lit.).
Ein Sonderfall ist die Mahd mit in der Naturschutzpflege regelmäßig eingesetzten Mähraupen, die vor allem auf sehr nassen und unzugänglichen Flächen zum Einsatz kommen. Sie nehmen das Mähgut direkt nach dem Schnitt in den Ladewagen auf, weitere Arbeitsgänge auf der Fläche entfallen. Hierbei ist mit einer hohen Ausfallsrate zu rechnen, da erfasste Raupengespinste direkt mit dem Mähgut abtransportiert werden. Mähraupen sollten daher eine gewisse Mindestmahdhöhe (7 bis 10 cm) einhalten und möglichst erst ab Mitte September eingesetzt werden, wenn sich die Larven im bodennahen Überwinterungsgespinst befinden.
Grundsätzlich muss betont werden, dass neben den hier analysierten Nutzungs-Parametern die Überlebensrate der Larven von einer Vielzahl weiterer Faktoren abhängig ist. Sehr regelmäßig wurden bei der Kontrolle der Raupengespinste die Puppen von Schlupfwespen (wahrscheinlich Cotesia bignellii ) gefunden, die in einigen Fällen offensichtlich Verluste kompletter Raupenkollektive verursachten. Es ist davon auszugehen, dass die Populationsschwankungen beim Goldenen Scheckenfalter hauptsächlich durch das antizyklische Auftreten dieses Parasitoiden gesteuert werden (vgl.Klapwijk & Lewis2014). Bei Untersuchungen in Großbritannien waren beispielsweise 25 % untersuchter Larven und 26 % untersuchter Raupengespinste vom Parasitoiden befallen (Klapwijk & Lewis2014).
Auch der jährliche Witterungsverlauf hat einen großen Einfluss auf die Überlebensrate der Larven. Beispielsweise führte der trocken-warme Sommer 2015 dazu, dass gerade in nährstoffarmen, stärker entwässerten Streuwiesen nur wenige geeignete Wirtspflanzen vorhanden waren, da die Trockenheit zu Kümmer- und Zwergwuchs beim Teufelsabbiss führte. Dementsprechend brachen einige Vorkommen auf derartigen Standorten trotz teilweise hoher Falterdichten im Frühsommer ein. Im Gegensatz dazu waren die Wirtspflanzen auf feuchteren, quelligen und etwas nährstoffreicheren Standorten gut ausgebildet, so dass hier in einigen Gebieten neue Rekordzahlen an Gespinsten erfasst werden konnten. Im eher durchwachsenen und regenreichen Sommer 2016 konnten dagegen auf trockenen Standorten regelmäßig hohe Gespinstzahlen an nun kräftigen Wirtspflanzen gefunden werden, während natürlicherweise feuchte Standorte durch die hohen Niederschlagssummen derart nass waren, dass sie als Reproduktionshabitate für E. aurinia komplett ausfielen. Dies unterstreicht die Wichtigkeit des Vorhandenseins verschieden strukturierter Habitate im räumlichen Verbund, das der Art ein Ausweichen bzw. eine Wiederbesiedlung verwaister Standorte ermöglicht (vgl. Antheset al. 2003a,Hulaet al. 2004).
Weitere Faktoren wie die Fahrgeschwindigkeit des Schleppers bei der Mahd, das Vorhandensein von Abstandshalterkufen zur Gewährleistung einer gleichmäßigen Mahdhöhe oder das Profil der Fläche (eben bis wellig) haben zwar einen Einfluss auf die Rate abgemähter Gespinste, sind aber im Endeffekt unerheblich, wenn davon ausgegangen wird, dass die Mahd keinen signifikanten Einfluss auf die Überlebensrate der Larven hat. Abstandshalterkufen könnten sich im Gegenteil sogar negativ auf das Mikroklima auswirken, da hierdurch eine Vereinheitlichung der Fläche und ihrer Vegetation erzielt wird und kleinflächige Sonderstrukturen wie z.B. Erdanrisse und Rohbodenstellen nur selten neu entstehen. Diese sind aber zum einen wichtig für die Keimung verschiedener Pflanzen (z.B.Lanverset al. 2012), darunter auch des Teufelsabbiss, zum anderen bieten sie geeignete mikroklimatische Bedingungen für die Entwicklung stark gefährdeter Arten wie Heilziest-Dickkopffalter ( Carcharodus flocciferus ) oder Buntbäuchigem Grashüpfer ( Omocestus rufipes ).
5 Empfehlungen für das Mahdmanagement
5.1 Gezielter Schutz des Goldenen Scheckenfalters
Die wichtigste Voraussetzung für den Erhalt des Goldenen Scheckenfalters ist die Aufrechterhaltung der Metapopulationsstrukturen in Form engmaschig verknüpfter Patches mit hoher Habitatqualität (vgl.Anthes & Nunner2006,Nunneret al. 2013). Dies bedeutet auch, dass Populationen nicht nur an ihren aktuellen Vorkommensorten gefördert, sondern darüber hinaus weitere verbindende Lebensräume als „Trittsteinbiotope“ oder dauerhafte Habitate geschaffen und entwickelt werden müssen. Über den Biotopschutz und den flächigen Abschluss von Pflegeverträgen nach der Landschaftspflegerichtlinie (LPR) auf den württembergischen Streuwiesen ist die Grundvoraussetzung hierfür gegeben.
Gängige Methoden des speziellen Schutzes des Goldenen Scheckenfalters in Niedermoorgebieten sind das Markieren und Aussparen einzelner Raupengespinste von der Mahd sowie das Belassen größerer Brachebereiche, die Gespinste enthalten (Anthes & Nunner2006). Hierdurch sollen die Raupengespinste vor direkten Verlusten durch die Mahd geschützt werden. Nach unseren Erkenntnissen sind diese speziellen Maßnahmen nicht notwendig. In Einzelfällen können sie sogar negative Auswirkungen auf das Vorkommen der Art haben. Zwar ist es möglich, über das Aussparen einzelner Gespinste das Überleben der Larven bis zum nächsten Frühjahr zu garantieren (abgesehen von externen Einflüssen wie Parasitoiden und Witterung), allerdings verändert auch ein kleinräumiges Aussetzen der Mahd die jeweilige Vegetationsstruktur im Larvalhabitat. Je nach Ausprägung der Fläche kann dieses erwünschte oder unerwünschte Effekte haben (Anthes & Nunner2006). Während in mageren, schwachwüchsigen Streuwiesen derartige Brachebereiche zwei bis drei Jahre lang als Larvalhabitate dienen können und junge Brachen sogar attraktiv auf die Weibchen des Goldenen Scheckenfalters wirken, kann die Habitateignung in wüchsigen, nährstoffreicheren Streuwiesen bereits bei einmaliger Mähpause erlöschen (vgl.Antheset al. 2003a, b,Bräu & Nunner2003,Anthes & Nunner2006). Die Wirtspflanzen werden überwachsen und kommen im Folgejahr nicht mehr für die Eiablage in Frage.
Beide Extremfälle wurden im Rahmen der Umsetzung des Artenschutzprogramms in den vergangenen Jahren mehrfach beobachtet. Das Aussparen von Bereichen von der Mahd kann also nur sinnvoll sein, wenn dadurch strukturell geeignete Jungbrachen geschaffen werden. So wurde bei der Streumahd mehrfach das gezielte Aussparen von Teilflächen mit kleinwüchsigen Teufelsabbiss-Pflanzen in etwas stärker entwässerten Flächen erprobt – allerdings mit wechselndem Erfolg. Davon wurde erhofft, dass die entstehenden Jungbrachen von eiablagewilligen Weibchen im Folgejahr bevorzugt angenommen werden, da sie mikroklimatisch günstig und die Pflanzen nach einjähriger Brache kräftiger entwickelt sind. In Einzelfällen konnten hierdurch tatsächlich eine Wiederbesiedlung der Art auf zuvor unbesiedelten Patches und hohe Gespinstzahlen in zuvor eher individuenschwachen Vorkommen erzielt werden. Meist jedoch blieben die Jungbrachen frei von Gespinstnachweisen, wohl v.a. deshalb, weil sich die Vegetationsstruktur anders entwickelt hatte als erwartet.
Der Witterungsverlauf des jeweiligen Jahres ist entscheidend, wo aufgrund von Nässe/Trockenheit und Vegetationswachstum geeignete Larvalhabitate entstehen, so dass es sehr schwierig ist, bereits im Vorjahr die zum Aussparen von der Mahd bestgeeigneten Kleinstandorte zu erkennen. Das selektive Aussparen markierter Raupengespinste von der Streumahd bei extrem kleinen Populationen (< 5 Raupengespinste) in kleinflächigen Larvalhabitaten produktiverer Standorte verhinderte jedenfalls nicht, dass im Folgejahr die bis dato noch geeigneten Habitatreste aufgegeben wurden.
5.2 Verzicht auf Individuenschutz
Die derzeitige Praxis der landschaftspflegerischen Streumahd basiert auf den Grundsätzen einer möglichst „schonenden“ Pflege mit späten Schnittzeitpunkten (je nach Ausprägung von Anfang September bis Mitte Oktober), großen Schnitthöhen (mindestens 7 cm) und der Belassung von Brachebereichen auf 5 bis 10 % der Fläche, um den Streuwiesenpflanzen das Aussamen zu ermöglichen und gleichzeitig vorkommende Tierarten (Amphibien, Heuschrecken, Schmetterlinge) nicht zu gefährden (vgl.Detzel1985,Humbertet al. 2010,Oppermann1987,Quingeret al. 1995,Quinger2003). Diese Empfehlungen resultieren zumeist aus Einzelbeobachtungen, die zwar zutreffen, unseres Erachtens aber falsch interpretiert wurden (z.B.Detzel1985,Humbertet al. 2010,Oppermann1987) (s.u.).
Nach den eigenen Befunden wird der negative Effekt der Mahd auf die Raupengespinste des Goldenen Scheckenfalters sowie auf Vermehrungsstadien anderer Insektenarten massiv überschätzt (vgl.Bräu & Nunner2003). Den Goldenen Scheckenfalter betreffend haben sowohl Mahdhöhe als auch Art des Mähwerks und Mahdzeitpunkt keinen signifikanten Einfluss auf die Überlebensrate der Larven. Viel wichtiger als der Schutz vor eventuellen Indivienverlusten durch die Mahd wäre die Wiederherstellung von Metapopulationen durch Schaffung geeigneter Reproduktionsbedingungen und Mikrohabitate in Form von nährstoffarmen Streuwiesen mit kräftigen Wirtspflanzen (vgl.Anthes & Nunner2006,Bräu & Nunner2003). Um dies zu erreichen, wäre in vielen Fällen zunächst eine relativ frühe (Ende August/Anfang September) und tief angesetzte Mahd (Schnitthöhe 3 bis 5 cm) von Vorteil, da zu diesem Zeitpunkt die Wirtspflanzen ihre Reservestoffe noch nicht in die Wurzeln eingelagert haben, ein tiefer Schnitt folglich die maximale Menge an Nährstoffen entziehen würde (vgl.Quingeret al. 1995,Quinger2003).
Ein entsprechendes Vorgehen entspräche in Teilen auch traditionellen Formen der Streuwiesenbewirtschaftung (Konold & Hackel1990,Quingeret al. 1995). Zwar wurden viele Streuwiesen traditionell erst ab Oktober bis in den Winter hinein gemäht, da zu diesem Zeitpunkt Mahd und Trocknung auf den nun gefrorenen Böden vereinfacht waren, gleichzeitig war aber auch eine frühe Mahd zur Heugewinnung ab Juli und im August gerade auf trockeneren Standorten nicht unüblich (Quingeret al. 1995).
Hierbei sind außerdem die unterschiedlichen Zielsetzungen und Rahmenbedingungen der traditionellen Streumahd und der heutigen „Naturschutzmahd“ zu berücksichtigen. Während früher eine späte Mahd in Zeiten eines ständigen Nährstoffmangels auch dazu diente, den Flächen möglichst wenige Nährstoffe zu entziehen (Quingeret al. 1995), ist aus heutiger Sicht mit Berücksichtigung der hohen Stickstoffeinträge aus der Luft und aus umgebenden Flächen ein maximaler Nährstoffaustrag notwendig. Negative Effekte auf andere Tierarten sind durch einen früheren Schnittzeitpunkt im beschriebenen Rahmen nicht zu erwarten. Beispielsweise haben die Heuschreckenarten der Streuwiesen (z.B. Warzenbeißer – Decticus verrucivorus , Sumpfgrashüpfer – Chorthippus montanus , Sumpfschrecke – Stethophyma grossum ) ihre Reproduktion im August mit der Eiablage in den Boden weitgehend abgeschlossen und die noch vorhandenen Imagines sind dann nahezu bedeutungslos für den Fortbestand der Population. Auch die meisten Pflanzenarten sind zu diesem Zeitpunkt in ihrer Entwicklung so weit fortgeschritten, dass zumindest ein ausreichender Anteil der Pflanzen aussamen kann. Spätblühende Pflanzenarten können eine Augustmahd tolerieren, solange die frühe Mahd nicht alljährlich durchgeführt wird (Quingeret al. 1995).
5.3 Frühmahd zur Aushagerung
Neben der Vorverlagerung des Mahdzeitpunktes ist auf besonders stark versaumten oder gar verschilften Flächen eine partielle Frühmahd zur Aushagerung dringend zu empfehlen. Diese sollte vornehmlich in Bereichen durchgeführt werden, die für E. aurinia aktuell nicht zur Reproduktion geeignet sind, aber dahin wieder entwickelt werden könnten. Nach unseren Erfahrungen hat sich eine frühe Mahd Ende Mai/Anfang Juni bewährt, da dadurch einerseits das Schilf geschwächt wird, andererseits die Streuwiesenvegetation noch die Chance erhält, im zweiten Aufwuchs zur Blüte und zum Fruchten zu kommen (vgl.Bräu & Nunner2003). Besondere Rücksicht ist hierbei natürlich auf Vorkommen von Wiesenbrütern (z.B. Braunkehlchen) zu nehmen. Ein weiterer positiver Effekt dieser Frühmahd ist die Freistellung des Heilziests ( Betonica officinalis ), der dann bevorzugt vom Heilziest-Dickkopffalter ( Carcharodus flocciferus ) als Eiablagepflanze angenommen wird.
Eine vorgezogene Mahd im Juli führt dagegen zu einem abgeschwächten Nährstoffentzug und beraubt die Streuwiesenvegetation der Möglichkeit, nochmals zur Blüte zu kommen, weshalb nach mehrjähriger Wiederholung einer Juli-Mahd unerwünschte Verschiebungen in Richtung einer zweischürigen Feuchtwiesenvegetation zu beobachten sind (vgl.Quinger2003). Eine weitere, im württembergischen Allgäu bisher nur in Ausnahmefällen eingesetzte Alternative ist die Durchführung einer hoch angesetzten (10 bis 20 cm Schnitthöhe) Schilfmahd im Juni. Hierbei werden das Schilf und der Obergrashorizont entfernt, jedoch die Blattrosetten des Teufelsabbiss verschont und diese damit offen zugänglich gemacht. Eine solche Mahd wird beispielsweise in Nord- und Ostdeutschland vor Beginn der Flugzeit durchgeführt (Brecht2014,Kretschmeret al. 2016,Thoss2004).
5.4 Für und Wider von Brachebereichen
Aus bislang vorliegenden Studien in Niedermoorgebieten geht hervor, dass junge Brachestadien in vielen Populationen des Goldenen Scheckenfalters einen entscheidenden Bestandteil des Larvalhabitats darstellen (Antheset al. 2003b,Bräu & Nunner2003,Doleket al. 2003,Hulaet al. 2004,Konvickaet al. 2003,Thoss2004), was im Rahmen der eigenen Untersuchungen nicht gänzlich bestätigt werden konnte. Zwar können junge Brachestadien unter besonderen Umständen als gute Larvalhabitate dienen (s.o.), häufig erfüllen sie aber in Zeiten hoher Nährstoffeinträge nicht mehr die Bedingungen für eine erfolgreiche Reproduktion des Goldenen Scheckenfalters. Die im Landkreis Ravensburg mittlerweile regelhaft eingeführten einjährigen Brachebereiche, die ca. 5 bis 10 % der Fläche einnehmen sollen, könnten für den Goldenen Scheckenfalter nur dann positiv wirken, wenn sie gezielt an geeigneten Stellen platziert würden. Dies wäre allerdings mit einem aufwändigen Management verbunden und könnte nicht den Landwirten überlassen werden, die Brachen aus Gründen der Praktikabilität häufig über mehrere Jahre an denselben (nämlich nassesten) Stellen anlegen.
Generell muss die in der Literatur häufig unterstellte Wirksamkeit solcher Brachebereiche als „Rückzugsräume für Insekten und kleine Wirbellose“ (z.B.Humbertet al. 2010) nach der Mahd im Grundsatz hinterfragt werden. Entscheidend ist, bei welchen bestandsgefährdeten Arten derartige Strukturen einen Nutzen auf Populationsebene leisten, der zumindest für einschürige Streuwiesen mit spätem Schnittzeitpunkt nicht oder nur ausnahmsweise gegeben zu sein scheint. Anzunehmen ist nach bisherigen Beobachtungen eine Abhängigkeit von frühen Brachestadien für die in Niedermoorgebieten auftretenden FFH-Arten Wald-Wiesenvögelchen ( Coenonympha hero ) und Stromtal-Wiesenvögelchen ( Coenonympha oedippus ) (Bräu & Dolek2013,Bräu & Schwibinger2013).
Hier steht aufgrund der europaweiten Schutzverantwortung und des sehr hohen Gefährdungsgrades außer Frage, dass Schutzkonzepte auf frühe Brachestadien von Pfeifengraswiesen abzielen müssen. Gleichwohl sind fast alle eigentlichen Arten der Streuwiesen an das „einschneidende Ereignis“ einer Spätmahd hervorragend angepasst und haben zum Zeitpunkt der Mahd ihre Reproduktion bereits abgeschlossen. Ihre Vermehrungsstadien (Eier, Larven) finden sich in den meisten Fällen an „sicheren“ Orten im Boden oder bodennah in der Streu. Hier sind sie sowohl durch die Bodennähe als auch durch ihre meist geringe Größe bestens vor den Mähwerken und den Reifen der Schlepper geschützt.
Diejenigen Arten (z.B. Langflügelige Schwertschrecke – Conocephalus fuscus oder Große Goldschrecke – Chrysochraon dispar ), die ihre Eier in überständiges Gras legen, das mit der Mahd entfernt wird, sind trotz dieses Umstands aktuell nicht gefährdet und in den württembergischen Nieder- und Zwischenmooren weit verbreitet. Ihr stetiges Vorkommen in Streuwiesenhabitaten spricht dafür, dass auch diese Arten Strategien (z.B. Eiablagen in abgeschnittene, hohle Stängel nach der Mahd) entwickelt haben, um dauerhaft auf jährlich gemähten Flächen zu überleben. Für diese Arten sind unter den heutigen Gegebenheiten zudem ausreichend Habitate in aufgelassenen Streuwiesen und in Saumbereichen entlang von Gräben vorhanden. Ein Blick in die Vergangenheit und auf historische Fotos verrät aber: Streuwiesen und umgebende Futterwiesen wurden – soweit es die Witterungsbedingungen zuließen – regelmäßig und vollständig genutzt. Brachebereiche konzentrierten sich auf wenige Säume z.B. entlang der Entwässerungsgräben (Quingeret al. 1995) oder fanden sich damals in frühen Sukzessionsstadien austragsgenutzter Wälder (Schwendungsflächen, Niederwald, Kahlschläge etc.).
Ein häufiges Argument, das für das Belassen von Brachen genannt wird, ist die heutzutage großflächig stattfindende maschinelle Mahd, die sich durch Fixierung von Mahdterminen unter Umständen auf ein einziges Wochenende konzentriert (z.B.Huemer1996). Im Gegensatz dazu wurden die Streuwiesen früher über mehrere Wochen hinweg gemäht, so dass bis in den Herbst hinein stets ein Mosaik aus gemähten und ungemähten Bereichen vorhanden war. Aber auch diesbezüglich kann hinterfragt werden, welche schutzbedürftigen Arten durch Komplettmahd Ende August/Anfang September noch nachhaltig geschädigt werden könnten (s.o.). Selbstverständlich sind kleinflächige Brachebereiche (max. 10 % der Fläche) für die vorkommenden Arten nicht schädlich, solange sie jährlich gewechselt werden. Insoweit kann dieser Ansatz im Sinne einer „Risikominimierung“ und einer allgemeinen Erhöhung der Strukturdiversität in bestimmten Fällen beibehalten werden (vgl.Bräu & Nunner2003), etwa wenn dadurch spezielle Artenschutzziele, wie ein verbessertes Sitzwartenangebot für das Braunkehlchen (überjährige Hochstauden) erreicht werden kann. Wichtig scheint dann jedoch die regelmäßige Kontrolle einer sachgerechten Umsetzung. Eine Ausweisung großflächiger Langzeitbrachen („Prozessschutzflächen“) sollte dagegen in Niedermoorbereichen von hoher bis herausragender artenschutzfachlicher Bedeutung bzw. in entsprechenden Potenzialflächen grundsätzlich vermieden werden.
Dank
Unser Dank geht besonders an Gabriel Hermann (Hildrizhausen) für die Überarbeitung des Manuskripts und zahlreiche hilfreiche Hinweise.
Literatur
Anthes, N., Fartmann, T., Hermann, G.(2003a): Wie lässt sich der Rückgang des Goldenen Scheckenfalters (Euphydryas aurinia ) in Mitteleuropa stoppen? Erkenntnisse aus populationsökologischen Studien in voralpinen Niedermoorgebieten und der Arealentwicklung in Deutschland. Naturschutz und Landschaftsplanung 35 (9), 279-287.
–, Fartmann, T., Hermann, G., Kaule, G.(2003b): Combining larval habitat quality and metapopulation structure – the key for successful management of pre-alpineEuphydryas aurinia colonies. Journal of Insect Conservation 7, 175-185.
–, Nunner, A.(2006): Populationsökologische Grundlagen für das Management des Goldenen Scheckenfalters,Euphydryas aurinia , in Mitteleuropa. In:Fartmann, T., Hermann, G., Hrsg., Larvalökologie von Tagfaltern und Widderchen in Mitteleuropa, Abh. Westf. Mus. Naturkde. 68 (3/4), 323-352.
Bräu, M., Dolek, M.(2013): Wald-WiesenvögelchenCoenonympha hero (Linnaeus, 1758). In:Bräu, M., Bolz, R., Kolbeck, H., Nunner, A., Voith, J., Wolf, W., Hrsg., Tagfalter in Bayern, Eugen Ulmer, Stuttgart, 472-475.
–, Nunner, A. (2003):Tierökologische Anforderungen an das Streuwiesen-Mahdmanagement mit kritischen Anmerkungen zur Effizienz der derzeitigen Pflegepraxis. Laufener Seminarbeitr. 1/03, 223-229.
–, Schwibinger, M.(2013): Stromtal-WiesenvögelchenCoenonympha oedippus (Fabricius, 1787). In:Bräu, M., Bolz, R., Kolbeck, H., Nunner, A., Voith, J., Wolf, W., Hrsg., Tagfalter in Bayern, Eugen Ulmer, Stuttgart, 460-463.
Brecht, M. (2014): Einfluss der Vegetationsstruktur auf die Eiablagepräferenzen vonEuphydryas aurinia anSuccisa pratensis -Standorten in Niedermooren Brandenburgs. Unveröff. Bachelorarb., HNE Eberswalde, 71 S.
Detzel, P. (1985): Die Auswirkung der Mahd auf die Heuschreckenfauna von Niedermoorwiesen. Veröff. Naturschutz Landschaftspfl. Bad.-Württ. 59/60, 345-360.
Dittrich, B.(2016): Einfluss der Mahd auf die Larven und Gespinste des vom Aussterben bedrohten EdelfaltersEuphydryas aurinia (Rott., 1775). Unveröff. Zulassungsarb., Univ. Tübingen, 64 S.
Dolek, M., Geyer, A., Freese, A.(2003): Beweidung von Feuchtflächen: Reproduktion vonEuphydryas aurinia auf Weiden. Unveröff. Gutachten i. A. Bayer. Landesamtes für Umweltschutz, Kulmbach.
Ebert, G., Rennwald, E.(Hrsg., 1991): Die Schmetterlinge Baden-Württembergs. Bd. 1, Tagfalter 1. Eugen Ulmer, Stuttgart, 552 S.
–, Hofmann, A., Meineke, J.-U., Steiner, A., Trusch, R.(2005): Rote Liste der Schmetterlinge (Macrolepidoptera) Baden-Württembergs (3. Fassung). In:Ebert, G., Hrsg., Die Schmetterlinge Baden-Württembergs. Band 10, Ergänzungsband. Eugen Ulmer, Stuttgart, 110-133.
Fischer, K.(1997): Zur Ökologie des Skabiosen-ScheckenfaltersEuphydryas aurinia (Rottemburg, 1775) (Lepidoptera: Nymphalidae). Nachr. Ent. Ver. Apollo 18, 287-300.
Ford, H.D., Ford, E.B.(1930): Fluctuation numbers, and its influence on variation inMelitaea aurinia , Rott. (Lepidoptera). Transactions of the Royal Entomological Society of London 78, 345-351.
Huemer, P.(1996): Frühzeitige Mahd, ein bedeutender Gefährdungsfaktor für Schmetterlinge der Streuwiesen (NSG Rheindelta, Vorarlberg, Österreich). Vorarlberger Naturschau 1, 265-300.
Hula, V., Konvicka, M., Pavlicko A., Fric, Z.(2004): Marsh Fritillary (Euphydryas aurinia ) in the Czech Republic: monitoring, metapopulation structure, and conservation of an endangered butterfly. Entomologica Fennica 15, 231-241.
Humbert, J.-Y., Richner, N., Sauter, T., Walter, T.(2010): Wiesen-Ernteprozesse und ihre Wirkung auf die Fauna. ART-Ber. 724, Forschungsanst. Agroscope, 12 S.
Klapwijk, M.J., Lewis,O.T.(2014): Spatial ecology of host-parasitoid interactions: a threatend butterfly and its specialised parasitoid. J. Insect Conserv.14, 237-246.
Konold, W., Hackel, A.(1990): Beitrag zur Geschichte der Streuwiesenkultur im Alpenvorland. Z. f. Agrargeschichte und Agrarsoziologie 38 (2), 176-191.
Konvicka, M., Hula, V., Fric, Z.(2003): Habitat of pre-hibernating larvae of the endangered butterflyEuphydryas aurinia (Lepidoptera: Nymphalidae): What can be learned from vegetation composition and architecture? European Journal of Entomology 100, 313-322.
Kretschmer, H., Salpeter, H., Gelbrecht, J.(2016): Ergebnisse zur Wiederansiedlung des Goldenen Scheckenfalters (Euphydryas aurinia Rottemburg, 1775) in Brandenburg – eine Bilanz nach zehn Jahren. Märkische Entomolog.Nachr. 17 (2), 219-238.
Lanvers, J., Sieg, B., Fartmann, T. (2012):Auswirkungen von Langlaufloipen auf Moorvegetation. Tuexenia 32, 87-103.
Nunner, A., Bräu, M., Bolz, R.(2013): Goldener Scheckenfalter –Euphydryas aurinia . In:Bräu, M., Bolz, R., Kolbeck, H., Nunner, A., Voith, J., W. Wolf, W., Tagfalter in Bayern, Eugen Ulmer, Stuttgart, 398-402.
Oppermann, R. (1987): Tierökologische Untersuchungen zum Biotopmanagement in Feuchtwiesen: Ergebnisse einer Feldstudie an Schmetterlingen und Heuschrecken im württembergischen Alpenvorland. Natur und Landschaft 62 (6), 235-241.
Porter, K.(1983): Multivoltinism inApanteles bignelli and the influence of weather on synchronisation with its hostEuphydryas aurinia . Entomologia Experimentalis et Apllicata 34 155-162.
Quinger, B., Schwab, U., Ringler, A., Bräu, M., Strohwasser, R., Weber, J.(1995): Lebensraumtyp Streuwiesen. Landschaftspflegekonzept Bayern, Band II.9, Laufen, 396 S.
Quinger, B.(2003): Empfehlungen zur Anwendung verschiedener Mahdmanagements zur Pflege der Streuwiesen im bayerischen Alpenvorland. Laufener Seminarbeitr. 1/03, 203-222.
Reinhardt, R., Bolz, R.(2011): Rote Liste und Gesamtartenliste der Tagfalter (Rhopalocera) (Lepidoptera: Papilionoidea et Hesperioidea) Deutschlands. In: Bundesamt für Naturschutz, Hrsg., Rote Liste gefährdeter Tiere, Pflanzen und Pilze Deutschlands – Bd. 3: Wirbellose Tiere (Teil 1). Naturschutz Biol. Vielfalt 70 (3), 167-194.
Thoss, S.(2004): Untersuchungen am Abbiß-ScheckenfalterEuphydryas aurinia Rott. als Grundlage artbezogener Biotopmanagement- und Monitoringmaßnahmen im „Grünen Band“ Sachsens. Unveröff. Dipl.-Arb., HNE Eberswalde, 74 S.
Fazit für die Praxis
Kontakt
Dr. Thomas Bamann wirkt seit 2012 als Mitarbeiter im Regierungspräsidium Tübingen – Referat 56 „Naturschutz und Landschaftspflege“, seit 2016 als Gebietsreferent für die Landkreise Ravensburg und Bodenseekreis. Zusätzlich ab 2013 freiberufliche Arbeit als Landschaftsökologe mit faunistischem Schwerpunkt, u.a. Umsetzung des Artenschutzprogrammes Schmetterlinge des Landes Baden-Württemberg. Studium der Biologie an der Eberhard-Karls-Universität Tübingen, Abschluss mit Promotion im Jahre 2015 über Tagfalter (GattungErebia ).
> Thomas.Bamann@rpt.bwl.de, t.bamann@web.de
Birgit Dittrich (geb. Reichel) studiert Biologie und Chemie an der Eberhard Karls Universität Tübingen mit dem Ziel Staatsexamen (Gymnasiallehramt). Zuvor Ausbildung zur Biologielaborantin und Berufstätigkeit am Max Planck Institut für Molekulare Zellbiologie und Genetik in Dresden (2005 bis 2012). Ehrenamtliche Tätigkeit bei der „Initiative Bunte Wiese Tübingen“.
> birgit.dittrich11@gmail.com, birgit.dittrich@student.uni-tuebingen.de
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen



Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.