Schutzmaßnahmen für den Frauenschuh
Abstracts
Der Frauenschuh (Cypripedium calceolus L.) ist eine europaweit gefährdete Art der Anhänge II und IV der FFH-Richtlinie, für die ein guter Erhaltungszustand ihrer Populationen gesetzlich gefordert ist. Im Rahmen eines vierjährigen Projekts wurden im Landkreis Neumarkt i.d. OPf. (Bayern) Managementmaßnahmen durchgeführt und mittels Lichtmessungen sowie eines Monitorings von Spross-, Blüten- und Fruchtzahlen die Wirksamkeit der Maßnahmen geprüft. Von 2011 bis 2014 haben die Spross- und Blütenzahlen von 22 untersuchten Beständen von C. calceolus zugenommen. Die Zunahme war in Beständen mit Freistellungsmaßnahmen und Maßnahmen zur Konkurrenzbeseitigung in der Krautschicht signifikant höher als in Beständen ohne Maßnahmen. Lichtmessungen ergaben, dass der Frauenschuh eine Lichtintensität bevorzugt, die 19 bis 34 % des gesamten eingestrahlten Lichtes unter freiem Himmel entspricht. Aussaatexperimente in vegetationsbefreiten Störflächen brachten im dritten Jahr nach Aussaat erste Jungpflanzen.
Protection measures for the Lady Slipper – Improvement of the conservation status of Cypripedium calceolus
The Lady Slipper Orchid (Cypripedium calceolus) is an endangered European species listed in the Appendices II and IV of the Habitats Directive. Management measures are mandatory to ensure a favourable conservation status of existing populations.
Within a four year study management measures were carried out in the county of Neumarkt i.d. OPf. (Bavaria). A monitoring was conducted by measuring light intensity and by investigating numbers of shoots, flowers and fruits. From 2011 to 2014 the numbers of shoots and flowers of C. calceolus increased in the 22 study sites. This increase was significantly higher in stands where clearances were carried out and where competition in the herb layer was reduced. Measurements of light intensity revealed that C. calceolus prefers a light intensity of 19 to 34 % of total insolation. Experimental sowings in plots with removed vegetation provided first seedlings in the third year after sowing.
- Veröffentlicht am
1 Einleitung
Der Frauenschuh (Cypripedium calceolus) (Abb. 1) ist in weiten Teilen Europas und insbesondere in Deutschland in den letzten 30 Jahren stark zurückgegangen (Hauke 2003, Ramsay & Stewart 1998, Terschuren 1998, Wood et al. 1984). Aufgrund dieses Rückgangs und der Verantwortung für den Erhalt der Art ist er in den Anhängen II und IV der FFH-Richtlinie gelistet, wodurch die Einrichtung von Schutzgebieten sowie eine Verbesserung des Erhaltungszustandes von Populationen der Art gesetzlich gefordert sind.
Als überwiegend boreale Art ist die Orchidee in der gemäßigten und (sub-)borealen Zone über ganz Eurasien verbreitet, sie stößt im Westen bis in die Pyrenäen und Großbritannien vor (Garcia et al. 2009, Kull 1999). Innerhalb Europas hat die Art in Mittel- bis Nordschweden und in West-Estland in borealen, krautreichen, frischen bis feuchten Fichtenwäldern sowie in einigen Regionen Polens ihre größten Vorkommen (Kull 1999, Terschuren 1998). In Mitteleuropa kommt die Art in halbschattigen Buchenwäldern oder Laubmischwäldern auf Kalk sowie in lichten Nadelwäldern auf Kalk oder Dolomit vor (Baumann et al. 2006, Oberdorfer 1990).
Sie wächst gern am Waldrand oder auf kleinen Lichtungen und Schneisen, wo mehr Licht als im Bestandsinneren zur Verfügung steht. Viele der Standorte befinden sich in einem Sukzessionsprozess, in dessen Verlauf der Standort für die Art zu dunkel wird (Baumann et al. 2006). Aus diesem Grund fokussiert das Management der Standorte überwiegend auf die Optimierung der Lichtverhältnisse durch Freistellungsmaßnahmen und Gehölzentnahmen. Die notwendige Intensität der Auflichtungen beruht auf Experteneinschätzungen, da belastbare quantitative Daten zu Lichtpräferenzen für Deutschland bisher fehlen. Trotzdem haben die Maßnahmen zumeist positive Effekte, können aber aufgrund zu starker Gehölzentnahmen z.B. durch Trockenstress auch gegenteilige Effekte haben. Populationen des Frauenschuhs leiden häufig auch unter zu starkem Konkurrenzdruck in der Krautschicht sowie generell unter der kaum vorhanden generativen Reproduktion in den meisten mitteleuropäischen Populationen (Baumann et al. 2006, Hauke 2003, Kull 1999).
Beide Aspekte werden beim Management bisher kaum berücksichtigt, da diesbezügliche Maßnahmen u.a. Störungen der Vegetationsdecke implizieren würden (vgl. Brunzel 2010). Da die Art in Deutschland aber nach wie vor als Charakterart des Orchideen-Buchenwalds gilt (Hauke 2003, Oberdorfer 1990), also eines natürlichen Lebensraumtyps, dessen Artengemeinschaft ohne Management auskommen sollte, stoßen weitergehende Maßnahmen insbesondere zur Verbesserung der generativen Reproduktionsmöglichkeiten auf große Vorbehalte.
Betrachtet man jedoch die Gesamtverbreitung der Art und insbesondere die Habitatpräferenzen in Nord- und Osteuropa, muss das Bild vom Frauenschuh als Charakterart des Orchideen-Buchenwaldes revidiert werden: Die Art wächst in Mitteleuropa nicht in lichten Orchideenbuchenwäldern, weil dieser Standort besonders geeignet wäre, sondern weil die Art mit ihrer ökologischen Amplitude dazu gerade noch in der Lage ist. Und auch in Mitteleuropa beherbergen nicht Buchenwälder die größten Vorkommen des Frauenschuhs, sondern z.B. Schneeheide-Kiefernwälder auf Kalk-Flussschottern am nördlichen Alpenrand (Baumann et al. 2006).
Der Frauenschuh ist wie alle Orchideen zur Keimung auf Mykorrhiza angewiesen, welche den Samen ankeimen (Obdrzalek 2009, Rasmussen 1995). Danach sind die Keime von der Versorgung durch die Mykorrhiza abhängig, da sie kein eigenes Nährgewebe besitzen (Nilson 1979, Rasmussen 1995). Zur Keimung und Etablierung früher Stadien in situ ist bisher wenig bekannt, jedoch bildet sich nach der Keimung zunächst ein Protokorm, der unterirdisch bleibt und mit einem ersten Blatt frühestens nach drei Jahren an der Oberfläche sichtbar wird (vgl. Curtis 1943, Fuchs & Ziegenspeck 1926, Lucke 1977 und 1978, Lucke mdl., Rasmussen 1995). Für diesen Prozess ist es notwendig, dass der Samen mit der Mykorrhiza in Kontakt treten kann.
Da sich die Mykorrhiza bevorzugt in den humosen, oberen Bodenschichten befindet, verhindert eine zu mächtige Streuauflage aus abgestorbenem Material oder eine dichte, geschlossene Vegetationsdecke die Möglichkeit, dass Samen keimen und sich Jungpflanzen etablieren können. In der Klärung günstiger Keimungs- und Etablierungsbedingungen in situ liegt damit ein großes Potenzial für Maßnahmen, die über Auflichtungen und Freistellungen hinausgehen.
In einem früheren Forschungsprojekt wurden hierzu erste Untersuchungen durchgeführt (vgl. Brunzel 2010). In einem auf vier Jahre angelegten Projekt zur Sicherung, Vermehrung und Entwicklung einer für ganz Bayern bedeutsamen Frauenschuhpopulation östlich von Neumarkt in der Oberpfalz wurden unterschiedliche Pflegemaßnahmen durchgeführt und durch begleitende Forschung ihre Wirksamkeit überprüft. Folgende Fragen standen hierbei im Vordergrund:
(1) Was sind die bevorzugten Lichtverhältnisse des Frauenschuhs im Untersuchungsgebiet und welcher optimale Kronenschluss lässt sich daraus ableiten?
(2) Wie entwickeln sich Bestände mit Freistellungsmaßnahmen und Maßnahmen zur Verbesserung der Konkurrenzsituation und ohne solche Maßnahmen?
(3) Lassen sich durch gezielte Aussaat in experimentell angelegten, vegetationsfreien Flächen Frauenschuh-Bestände neu begründen?
2 Untersuchungsgebiet und Methoden
2.1 Nutzungsgeschichte des Untersuchungsgebietes
Das Untersuchungsgebiet liegt auf einer Dolomitkuppe östlich der Stadt Neumarkt i.d. OPf. ca. 530m ü. NN im Bereich der Hochfläche des Naturraums Mittlere Frankenalb, im Bereich der sog. „Kuppenalb“. Die Dolomitkuppe ist Teil des FFH-Gebiets „Wälder im Oberpfälzer Jura“, das außerhalb der Schneeheide-Kiefernwälder am Alpenrand die größten Frauenschuhvorkommen Deutschlands beherbergt. Vorschläge für Pflegemaßnahmen bestehen in der Erhaltung der halbschattigen Verhältnisse durch punktuelle Entnahmen von beschattenden Ästen und Bäumen.
Im zentralen Teil des Untersuchungsgebiets, in dem sich der Hauptteil der Frauenschuhbestände befindet (Abb. 2, eingekreist), herrscht ein Mosaik aus verbrachten Magerrasen und lichten Waldbeständen aus Kiefern und Fichten unterschiedlichen Alters: Der Großteil der Kiefern und Fichten sind Altersklassenbestände von bis zu 50 Jahren, einzeln stehende Fichten sind deutlich älter (80–100 Jahre). Bei dem Waldbestand im Untersuchungsgebiet handelt es sich um einen „Dolomit-Kiefernwald“, der in der ersten Hälfte des 20. Jahrhunderts in weiten Bereichen mit Fichten bepflanzt wurde. Natürlicherweise wäre die Dolomitkuppe mit einem sogenannten Dolomit-Kiefernwald (Anemono-Pinetum Hohenester) bestockt, einer Assoziation aus dem Verband des Erico-Pinion Br.-Bl. (Schnee-Heide-Kiefernwälder). Vor Ort würde demnach ein Mischwald aus vorherrschender Waldkiefer mit Anteilen von Eichen und Rotbuchen wachsen.
Bis in den Zweiten Weltkrieg war der Waldbestand lückig und mit dem heutigen Zustand vergleichbar (vgl. Abb. 2), allerdings wurde der Wald mit Rindern und Schafen beweidet. Etwa 1955 wurde der Wald gerodet, wobei einzelne Fichten stehengelassen wurden. Diese älteren Fichten haben mittlerweile bis 50cm Stammdurchmesser und über 20m Höhe erreicht. Da die Beweidung in den 1970er-Jahren zum Erliegen kam, wuchsen die Freiflächen durch Fichten- und Kiefernjungwuchs nach und nach zu (vgl. Abb. 2). Die Fichten haben durch Wachstum und Verjüngung stellenweise sehr dichte und dadurch dunkle Bestandsstrukturen erreicht, unter denen sich eine dichte Nadelstreu- und Moosschicht gebildet hat. Nur am Südhang der Kuppe und auf der zentralen Hochfläche haben sich noch offene Magerrasenbereiche gehalten.
Die Krautschicht der mehr oder weniger lichten Kiefern-Fichtenwälder wird von Fiederzwenke (Brachypodium pinnatum) und Blaugrüner Segge (Carex flacca) dominiert. Der Frauenschuh ist im Untersuchungsgebiet u.a. mit folgenden seltenen und gefährdeten Arten vergesellschaftet: Fliegen-Ragwurz (Ophrys insectifera), Kurzblättrige Stendelwurz (Epipactis distans), Breitblättrige Stendelwurz (E. helleborine), Braunrote Stendelwurz (E. atrorubens), Rotes Waldvöglein (Cephalanthera rubra), Weißes Waldvöglein (C. damasonium), Langblättriges Waldvöglein (C. longifolia), Vogel-Nestwurz (Neottia nidus-avis), Großes Zweiblatt (Listera ovata), Zweiblättrige Waldhyazinthe (Platanthera bifolia), Grünliche Waldhyazinthe (P. chlorantha), Kriechendes Netzblatt (Goodyera repens), Kreuz-Enzian (Gentiana cruciata), Deutscher Fransenenzian (Gentianella germanica), Gewöhnlicher Fransenenzian (G. ciliata).
2.2 Maßnahmen und Untersuchungsmethoden
2.2.1 Maßnahmen
Im Juni 2011 wurden zur Verbesserung des Lichtregimes fünf Bestände des Frauenschuhs teilweise freigestellt. Hierzu wurden benachbarte Fichten teilweise entastet, ca. zehn kleine bis größere Fichten wurden entnommen. Ebenfalls in fünf Fällen wurden um die Stöcke herum die Vegetation und die oberste Humusschicht auf einer Fläche von 0,5x0,5m so entfernt, dass diese von vegetationsfreiem Boden umgeben waren. Dies geschah in Anlehnung an Brunzel (2010), um den Konkurrenzdruck der umgebenden Krautschicht auf die Stöcke sowie die Streuschicht zu verringern, die ein Spross im Frühling durchdringen muss, bevor er ans Licht kommt und assimilieren kann.
Aus arbeitstechnischen Gründen geschah dies an vier Stöcken, an denen auch schon Freistellungsmaßnahmen durchgeführt worden waren. An je einem Stock wurde entweder nur eine Freistellung durchgeführt oder nur die Vegetations- und Streuschicht entfernt, so dass insgesamt sechs Stöcke mit Verbesserungsmaßnahmen vorhanden waren. Einer der Bestände ist im Herbst 2013 unter Fichtenschlagabraum verschwunden, weshalb in Analysen bis einschließlich 2014 nur noch fünf Maßnahmenbestände, in Analysen bis 2013 jedoch sechs Maßnahmenbestände berücksichtigt werden konnten.
In 2011 wurden erste Aussaatexperimente durchgeführt. Hierzu wurden vier je 1m² große Flächen geplaggt, d.h. Vegetation, abgestorbenes Material (Grasfilz) und oberste (Roh-)Humusschicht in einer Mächtigkeit von ca. 5cm bis auf dem humosen Oberboden entfernt. Auf diese Flächen wurden im Oktober 2011 Frauenschuhsamen mit Hilfe eines medizinischen Mikrolöffels ausgebracht, die direkt zuvor aus reifen Fruchtkapseln am jeweiligen Standort entnommen worden waren. Zwei dieser Flächen befanden sich in ca. 2m Entfernung zum nächsten Frauenschuhstock, zwei waren ca. 15m vom nächsten Bestand entfernt. Auch bei einer Entfernung von 2m zum nächsten Stock kann jedoch ausgeschlossen werden, dass Rhizome des Stocks in wenigen Jahren vegetativ in die Aussaatfläche einwachsen können (vgl. Kull 1999). Es kann jedoch nicht völlig ausgeschlossen werden, dass Früchte der benachbarten Stöcke von selbst in die Flächen ausgesamt haben, da beide benachbarten Stöcke im Oktober 2011 je eine reife Frucht aufwiesen.
In einem zweiten Ansatz von Aussaatexperimenten wurden im Herbst 2012 zwei Aussaatflächen von je 40m² angelegt. Dies geschah in ähnlicher Weise wie 2011, nur wurde ein Motor-Vertikutierer benutzt. Hierbei wurden die Flächen so lange vertikutiert und dann abgerecht, bis die Flächen zu ca. 80 % nackten Boden und zu 20 % eine dünne Streu- und Moosrest-Auflage aufwiesen.
2.2.2 Untersuchungsmethoden
Ab Mai 2011 wurden an den sechs (ab 2013 fünf) Maßnahmenbeständen und an acht Beständen, die die Kontrollgruppe für die Maßnahmenbestände bilden, die Sprosse, die Anzahl der blühenden Sprosse sowie die Anzahl der Früchte gezählt. Ab Mai 2012 wurden zusätzlich weitere neun Bestände in das Monitoring der Spross-, Blüten-, und Fruchtzahlen miteinbezogen, die 2011 noch nicht vorgefunden worden waren. Ab 2012 wurden damit insgesamt an 22 Beständen durchgehend Zählungen im Mai jeden Jahres durchgeführt.
Um die Auswirkungen der Freistellungsmaßnahmen auf die Lichtverfügbarkeit zu dokumentieren, wurden an den Beständen mit Maßnahmen unmittelbar vor und nach der Maßnahme sowie zeitnah auch an den Kontrollbeständen Lichtmessungen mit einem Luxmeter (PCE-Instruments, Mod. PCE-222) durchgeführt. Bei den Lichtmessungen wurde generell so vorgegangen, dass an jedem Bestand/Stock in einem Radius von ca. 1,5m innerhalb von 5min fünf Einzelmessungen des eingestrahlten Lichts vorgenommen wurden. Das bedeutet, dass an den fünf Beständen mit Freistellungsmaßnahmen vor und nach der Maßnahme insgesamt 50 Einzelmessungen durchgeführt wurden.
Um eine generelle Abhängigkeit der Bestände und ihrer Vitalität von der vorhandenen Lichtintensität zu analysieren, wurden an den 22 Beständen am 22.10. 2012, 13.05.2013 und 22.05.2014 mit dem Luxmeter insgesamt 345 Messungen in gleicher Weise wie oben durchgeführt. Gleichzeitig fand an jedem der drei Termine eine Referenzmessung unter freiem Himmel auf der zentralen Magerrasenfläche im Untersuchungsgebiet statt. Die Messungen fanden an jedem der drei Termine zwischen 13.00 und 16.00 Uhr statt. An allen Terminen war der Himmel wechselnd leicht bewölkt, die einzelnen Messungen wurden allerdings fast ausnahmslos in unbewölkten Lücken durchgeführt. Weiterhin wurde bei den Lichtmessungen zur besseren Vergleichbarkeit der 22 Bestände darauf geachtet, dass sie innerhalb von 90min abgeschlossen waren. Da bei Lichtmessungen dennoch große Schwankungen der Werte zu beobachten sind, wurden dann alle Einzelmessungen aller Termine gemittelt, um einen robusten Wert für die Vergleichbarkeit der Bestände untereinander zu erhalten (Tab. 1).
Die statistischen Analysen wurden im Falle der Veränderungen der Lichtverhältnisse und des Anteils blühender Sprosse vor und nach Maßnahmen mittels U-Test durchgeführt, da die Daten nicht normalverteilt waren. Für die Analyse des Zusammenhangs zwischen Lichtintensität und Sprosszahlen bzw. Zahl blühender Sprosse sowie der Fruchtzahl wurde aufgrund des nichtlinearen Zusammenhangs zwischen erklärender Variable und Antwortvariable und der nicht normalverteilten Fehlerverteilung ein generalisiertes lineares Modell (GLM) gewählt. Dem Zusammenhang zwischen Bestandsgröße und Fruchtrate liegt dagegen wieder ein einfaches lineares Regressionsmodell zu Grunde.
3 Ergebnisse
Die Gesamtzahl der Sprosse und die Anzahl blühender Sprosse hat von 2011 bis 2014 im Mittel aller 22 untersuchten Bestände zugenommen, nicht aber die Anzahl der Früchte (Abb. 3). Von 2013 auf 2014 zeigt die Sprosszahl wieder einen leichten Rückgang, die Anzahl blühender Sprosse steigt weiter, wenn auch deutlich weniger als in den Jahren zuvor.
Abb. 4 illustriert den Zusammenhang zwischen der über alle Messungen gemittelten Lichtintensität der 22 untersuchten Bestände und der mittleren Sprosszahl 2012 bis 2014 (a) sowie den gleichen Zusammenhang für die mittlere Anzahl blühender Sprosse 2012 bis 2014 (b). Der Frauenschuh zeigt im Untersuchungsgebiet sowohl hinsichtlich der Sprosszahlen als auch der Anzahl blühender Sprosse eine deutliche Präferenz für eine mittlere Lichtintensität von 1300 bis 2300lux. Dieser Zusammenhang ist in einem generalisierten linearen Modell höchstsignifikant. In Relation zu den zeitgleich im Mittel gemessen 6700lux Lichtintensität unter freiem Himmel bedeutet dies, dass der Frauenschuh Lichtverhältnisse bevorzugt, die im Untersuchungsgebiet 19 bis 34 % des Freilandlichtes aufweisen.
Abb. 5 zeigt, dass es keinen statistisch absicherbaren Zusammenhang zwischen Lichtintensität und Fruchtrate der Bestände gibt. Ebenfalls erweist sich im Untersuchungsgebiet ein möglicher positiver Zusammenhang zwischen Größe der Bestände (Blütenreichtum) und Befruchtungsrate – vermittelt über eine erhöhte Attraktivität großer Bestände für Bestäuber – als statistisch nicht signifikant (p=0.95, Abb. 6).
Von den sechs untersuchten Beständen mit Maßnahmen wurden an fünf Beständen beide Maßnahmen gleichzeitig durchgeführt:
Zwecks Auflichtung wurden zum einen Äste und Bäume entfernt. Erwartungsgemäß war die gemessene Lichtintensität nach Entnahme von Bäumen und Ästen signifikant höher als vorher (U-Test, p≤ 0.001).
Zum anderen wurde die Vegetation um Stöcke herum zur Reduktion von Konkurrenz in der Krautschicht entfernt.
An jeweils einem Bestand wurde nur die eine oder die andere Maßnahme durchgeführt. Die Analysen beziehen sich daher immer auf die Maßnahmen in Kombination. Die Ergebnisse zeigen die Auswirkung der Maßnahmen auf das Blühverhalten der untersuchten Bestände: Die Veränderung der Blühraten (Prozent der blühenden Sprosse, 2011=100 %) von 2011 auf 2013 war bei Beständen mit Maßnahmen signifikant höher als bei Beständen ohne Maßnahme (U-Test, p≤0.05), (Abb. 7).
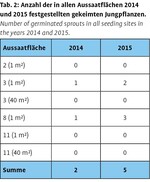
In den fünf 2011 angelegten Aussaatflächen von je 1m² Größe konnte erstmals 2014 im dritten Jahr nach der Aussaat je eine Jungpflanze im Einblattstadium mit kleinem Scheideblatt entdeckt werden (Abb. 8). In 2015 wurden in diesen beiden Aussaatflächen (Bestände 8 und 3) dann drei (Bestand 8) bzw. zwei Jungpflanzen (Bestand 3) festgestellt (Tab. 2). In den beiden großen Aussaatflächen aus 2012 konnten dagegen trotz intensiver Nachsuche 2015 keine gekeimten Jungpflanzen gefunden werden.
4 Diskussion
4.1 Habitatpräferenzen des Frauenschuhs
Der Frauenschuh bewohnt in weiten Teilen seines Verbreitungsgebiets boreale und subboreale, frische bis feuchte Nadelwälder (Kull 1999, Terschuren 1998). Diese Tatsache weist daraufhin, dass die Art sich empfindlich gegenüber Trockenheit verhält und gerade Jungpflanzen konstante Feuchtigkeit benötigen (Kull 1999). Auch hinsichtlich der Lichtpräferenzen liefert der Lebensraum des borealen Nadelwaldes Hinweise: Für die südlichen Taigazonen gibt schon Dementjeva (1985, in Kull 1999) als Optimum 1/14 bis 1/20 des totalen Lichts als Optimum an. Dies weist gegenüber den vorliegenden Untersuchungen auf deutlich schattigere Verhältnisse hin. Demgegenüber gibt es aber auch Vorkommen in nahezu unbeschatteten Verhältnissen, z.B. am Rande von Kalk-Magerrasen in Hessen (Hessen-Forst FENA 2014) oder an der Baumgrenze in den Alpen (Kull 1999).
Besonders relevant scheint hinsichtlich der Beschattung weniger der Kronenschluss der obersten Baumschicht zu sein, sondern vielmehr der Deckungsgrad der Strauchschicht und der jungen Bäume. Noch wichtiger ist wohl der Konkurrenzdruck in der Krautschicht nach Durchforstungen und damit verbundenen Auflichtungen: So leidet der Frauenschuh nach zu starken Auflichtungen sehr stark unter dieser Konkurrenz (Kull 1999, Nicolé et al. 2005). Dagegen konnten in polnischen Beständen keine signifikanten Veränderungen nach Durchforstungen der obersten Baumschicht festgestellt werden (Czerepko et al. 2014).
Neben der räumlichen spielt die zeitliche Einnischung in die Sukzessionsfolge hin zu geschlossenen Waldbeständen eine große Rolle. Es ist zu vermuten, dass sich viele Frauenschuhbestände in Mitteleuropa in einem relativ engen Zeitfenster im Verlauf der Sukzession von Offenland (ehemaligen Magerrasen, Schotterbänken, Hangrutschungen) hin zu Wald bei ganz bestimmten Belichtungsverhältnissen etabliert haben. Das ist höchstwahrscheinlich im Untersuchungsgebiet der Fall, wo sich die Bestände der Hauptuntersuchungsfläche wohl irgendwann im Verlauf der 1970er-Jahre etabliert haben müssen. Dieses gilt ebenfalls für die Etablierung von Beständen in einem bestimmten Sukzessionsstadium von ehemals offenen Flächen in den Pyrenäen (Garcia et al. 2009). Bei Beurteilungen zur zeitlichen Einnischung ist zu beachten, dass Individuen problemlos 30 Jahre alt werden können, einige wohl sogar über 100 Jahre (Kull 1999). Inwieweit hier die Fähigkeit der Art, z.B. Umweltstress mit Dormanz zu überdauern (Shefferson et al. 2005), eine Rolle spielt, ist weitgehend ungeklärt.
Der zu Boden fallende Samen muss zur Keimung die Mykorrhiza im Boden erreichen, kann aber auch über einen gewissen Zeitraum im Boden in einer Samenbank überdauern (Cribb 1997, Pedersen et al. 2012, Ramsay & Stewart 1998, Rasmussen 1995). Nach einer erfolgreichen Keimung benötigt die Pflanze laut Rasmussen (1995) sechs bis zehn Jahre bis zur ersten Blüte, andere Quellen berichten von fünf Jahren nach Aussaat (Lucke mündl., Lucke 1978). Die generative Reproduktion ist generell eher gering, das Verhältnis von generativer zu vegetativer Vermehrung wird auf 1:200 geschätzt (Kull 1998, 1999).
In diesem Zusammenhang sind auch die generell niedrigen Fruchtraten zu diskutieren: In acht estnischen Populationen lag die mittlere Fruchtrate über elf Jahre bei 10,5 % (Kull 1998), in Schweden wurden dagegen bis zu 25 % beobachtet (Nilson 1979). Kull (1998) beschreibt, dass der Prozentsatz der Früchte in größeren Populationen nicht größer als in kleineren ist. Die gängige Annahme, dass die Lichtintensität am Standort Einfluss auf die Attraktivität für Bestäuber und damit auf die Fruchtrate hat, kann übereinstimmend mit Kull (1998) für die Bestände im Untersuchungsgebiet ebenso nicht bestätigt werden wie die Hypothese, dass blütenreichere (größere) Bestände für Bestäuber aus Energieeffizienzgründen attraktiver sind und deshalb häufiger angeflogen werden, was sich ebenfalls positiv auf die Befruchtungsrate auswirken sollte (vgl. Abb. 5 und 6).
4.2 Empfehlungen zum Management von Beständen des Frauenschuhs
Unabhängig davon, für welchen Lebensraum oder Waldtyp man Cypripedium calceolus als charakteristisch annimmt, wird die Art in den von Laubwäldern dominierten Bereichen Mitteleuropas in den meisten Situationen auf Pflegemaßnahmen angewiesen sein. Aufgrund der in dieser Studie durchgeführten Untersuchungen können Empfehlungen für geeignete Maßnahmen zur Verbesserung des Erhaltungszustandes von Populationen des Frauenschuhs gegeben werden.
4.2.1 Auflichtungen zur Erreichung optimaler Lichtverhältnisse
Aufgrund der gemittelten Werte der Lichtmessungen liegt die optimale Lichtintensität für die Frauenschuhbestände im Untersuchungsgebiet zwischen 1300 und 2300 lux. Da dieser Wert wie auch der Referenzwert im Freiland sehr stark mit der Einstrahlungsintensität des jeweiligen Messtages schwankt (vgl. Tab. 1), ist es im Hinblick auf Auflichtungsmaßnahmen zielführender, die Messungen an einem konkreten Bestand in Relation zu einem gleichzeitig gemessenen Lichtwert unter freiem Himmel zu setzen.
Das Mittel der Freiflächenmessungen von 2012 bis 2014 beträgt ca. 6700 lux. Daraus ergibt sich, dass die optimale Lichtintensität für die Frauenschuhbestände im Untersuchungsgebiet zwischen 19 und 34 % der gesamten eingestrahlten Lichtintensität beträgt. Daraus folgt umgekehrt, dass die optimale Beschattung (abhängig von Kronenschluss und Wuchsdichte der Bäume) bei ca. 60 bis 80 % liegen sollte. Das bedeutet, dass der Frauenschuh im Untersuchungsgebiet keine Halbschatten-, sondern eine „Zweidrittel“- bis „Dreiviertelschatten-Pflanze“ ist.
Der Vergleich von Beständen mit Freistellungsmaßnahmen und Maßnahmen zur Verringerung der Konkurrenz in der Krautschicht mit Beständen ohne solche Maßnahmen macht deutlich, dass sich die Blührate der Bestände mit Maßnahmen signifikant erhöht hat (vgl. Abb. 7). In der vorliegenden Studie konnten Freistellungsmaßnahmen und Maßnahmen zur Verringerung der Konkurrenz nicht getrennt werden. Ergebnisse von Brunzel (2010) weisen jedoch darauf hin, dass auch allein die Verringerung der Konkurrenz in der Krautschicht zu einer Erhöhung der Anzahl blühender Sprosse führen kann.
Die Durchführung von Freistellungs-Maßnahmen sollte schrittweise erfolgen und über mehrere Jahre verteilt werden. Bei jedem Schritt sollte nur jeweils die Hälfte der geplanten Gesamtreduktion des Kronenschlusses durchgeführt werden. Auf diese Weise kann vermieden werden, dass Bestände durch einen sehr trocken-warmen Frühling nach den Freistellungsmaßnahmen zusammenbrechen.
4.2.2 Extensive Beweidung
Im Untersuchungsgebiet würde sich eine extensive Schafbeweidung der lichten Kiefern-Fichtenwälder in den Bereichen mit Frauenschuhbeständen etwa alle zwei Jahre wahrscheinlich positiv auf die Bestände des Frauenschuhs und der mit ihm vergesellschafteten Orchideen- und Enzianarten auswirken. Eine häufigere Beweidung würde den Charakter des Waldes auf Dauer vermutlich zu sehr in Richtung Offenland verändern und erscheint auch nicht notwendig. Luftbilder und eine Befragung der Grundstückseigentümer haben eine frühere Beweidung und Waldweidenutzung der Bereiche mit Frauenschuhbeständen bis in die 1970er-Jahre bestätigt.
Die Ergebnisse dieser Studie und ebenso verschiedener anderer Untersuchungen (Brunzel 2010, Kull 1999, Nicolé et al. 2005) weisen darauf hin, dass der Frauenschuh von einer lückigen und kurzen Vegetation profitiert. Die Beweidung und die damit verbundene Beseitigung von Vegetationsfilz sowie die Schaffung von kleinräumigen Vegetationslücken als Keimnischen sollten sich grundsätzlich positiv auf die generative Reproduktion des Frauenschuhs auswirken.
Zu beachten ist bei einer extensiven Beweidung jedoch, dass die Beweidungstermine optimalerweise von Ende August bis Ende März liegen sollten, damit die Frauenschuhbestände und andere Zielarten nicht zu stark geschädigt werden. Ebenfalls sollte darauf geachtet werden, dass die Beweidungsdichte so niedrig ist, dass Trittschäden in den Frauenschuhbeständen möglichst gering bleiben und junge Bäume nicht verbissen werden. Da zur optimalen Beweidungsdichte unter den dargestellten Umständen keinerlei belastbare Erfahrungswerte vorhanden sind, besteht hier Forschungsbedarf.
4.2.3 Aussaaten
Mit mindestens fünf definitiv auf Keimung in den 1-m²-Aussaatflächen zurückzuführenden Jungpflanzen zeigen die Aussaatexperimente, dass bei geeigneter Vorbereitung von Flächen Frauenschuhbestände durch Aussaat neu begründet werden können. Ob dies in kleinen oder großen Flächen, in räumlicher Nähe zu anderen Beständen oder durch die im Projekt durchgeführte oder auch andere Bodenvorbereitungen besser oder schlechter gelingt, kann aufgrund der geringen Stichprobenzahl der Aussaatexperimente nicht geprüft werden.
Dank
Wir danken Stefan Weigl vom Landratsamt Neumarkt für die freundliche und konstruktive Unterstützung der Untersuchungen sowie Christian Wolf für die Bereitstellung der historischen Luftbilder.
Literatur
Baumann, H., Künkele, S., Lorenz, R. (2006): Die Orchideen Europas. Ulmer, Stuttgart, 25.
Brunzel, S. (2010): Ex-situ-Kultivierung und In-situ-Management als Beitrag zum Artenschutz am Beispiel von Frauenschuh (Cypripedium calceolus), Sumpf-Gladiole (Gladiolus palustris), Böhmischer Enzian (Gentianella bohemica) und Karpaten-Enzian (Gentianella lutescens). Naturschutz und Landschaftsplanung 42 (5), 148-156.
Cribb, P. (1997): The Genus Cypripedium. Kew Publishing. Royal Botanic Gardens, Kew, 2. Ed.
Curtis, J.T. (1943): Germination and seedling development in five species of Cypripedium L. American J. Bot. 30, 199-205.
Czerepko, J., Gawrys, R., Ciesla, A., Sokolowski, K. (2014): Environment conditions influence on protection status of lady’s slipper orchid Cypripedium calceolus L. in managed forests. Sylvan 158, 867-874.
Fuchs, A., Ziegenspeck, H. (1926): Entwicklungsgeschichte der Axen der einheimischen Orchideen und ihre Physiologie und Biologie. Teil 1. Botanisches Archiv 14, 165-260.
Garcia, M., Goni, D., Guzman, D. (2009): Living at the edge: local versus positional factors in the long-term population dynamics of an endangered orchid. Conserv. Biol. 24, 1219-1229.
Hauke, U. (2003): Cypripedium calceolus L. In: Petersen, B., Ellwanger, G., Biewald, G., Hauke, U., Ludwig, G., Pretscher, P., Schröder, E., Ssymank, A., Bearb., Das europäische Schutzgebietssystem Natura 2000, Ökologie und Verbreitung von Arten der FFH -Richtlinie in Deutschland, Band 1: Pflanzen und Wirbellose, Schr.-R. Landschaftspfl. Naturschutz 69 (1), 76-82.
Hessen-Forst FENA (2014): Der Frauenschuh in Hessen. Artenschutzinfo Nr. 11. Hessen-Forst, Servicezentrum Forsteinrichtung und Naturschutz, Hrsg., 27 S.
Kull, T. (1998): Fruit-set and recruitment in populations of Cypripedium calceolus L. in Estonia. Botanical Journal of the Linnean Society 126, 27–38.
– (1999): Cypripedium calceolus. L.J. Ecol. 87, 913–924.
Lucke, E. (1977): Orchideenkultur für alle. Albrecht Philler, Minden, 3. Aufl.
– (1978): Zur Samenvermehrung der Orchideen in ihren natürlichen Biotopen. Orchidee 29, 116-123.
Nicolé, F., Brzsosko, E., Till-Bottraud, I. (2005): Population viability analysis of Cypripedium calceolus in a protected area: longevity, stability and persistence. J. Ecol. 93, 716-726.
Nilson, L.A. (1979): Authecological studies on the Lady´s Slipper, Cypripedium calceolus (Orchidaceae). Botaniska Notiser 132, 329-347.
Obdrzalek, J. (2009): Cultivation of Cypripedium calceolus L. ex vitro seedlings in outdoor conditions. Horticultura Science (Hort. Sci.) 36, 162-170.
Oberdorfer, E. (1990): Pflanzensoziologische Exkursionsflora. Ulmer, Stuttgart.
Pedersen, H.A.E., Rasmussen, H.N., Kahandawala, I.M., Fay, M.F. (2012): Genetic diversity, compatibility patterns and seed quality in isolated populations of Cypripedium calceolus (Orchidaceae). Conservation genetics 13, 89-98.
Ramsay, M.M., Stewart, J. (1998): Re-establishment of the lady´s slipper orchid (Cypripedium calceolus L.) in Britain. Botanical Journal of the Linnean Society 126, 173-181.
Rasmussen, H.N. (1995): Terrestrial Orchids – from seed to mycotrophic plant. Cambridge University Press, Cambridge.
Shefferson, R.P., Kull, T., Tali, K. (2005): Adult whole-plant dormancy induced by stess in long-lived orchids. Ecology 86, 3099-3104.
Terschuren, J. (1998): Action plan for Cypripedium calceolus in Europe – Report to the Council of Europe. Convention on the Conservation of European Wildlife and Natural Habitats. T-PVS(98)20. Council of Europe, Strasbourg, France.
Wood, J., Clements, M., Muir, H. (1984): Plants in peril, 2. Kew Magazine 1, 139-142.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen










Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.