Tyrphobionte Schmetterlingsarten nährstoffarmer Moore
Abstracts
Der Klimawandel wird die Lebensräume der an nährstoffarme Moore gebundenen, häufig stark isolierten Schmetterlingsarten immer mehr beeinflussen. Die Insekten sind hier u.a. an ein kühleres Eigenklima der Moore, an spezielle edaphische Bedingungen und an eine spezifische Pflanzenzusammensetzung gekoppelt. Es ist deshalb wichtig, die besonders sensiblen Arten und deren autökologischen Ansprüche genau zu kennen.
Vor diesem Hintergrund werden die tyrphobionten und tyrphophilen Arten von Hoch- und Zwischenmooren anhand konkreter Parameter voneinander abgegrenzt. Dazu finden u.a. die Fraßpflanzen der Raupen, der Verbreitungstyp, die mikroklimatischen Präferenzen und wesentlichen besiedelten Strukturen als Kriterien Beachtung. Es wird zudem ein Einblick in die postglaziale Entwicklungsgeschichte des mitteleuropäischen Raumes gegeben (inkl. pleisto- sowie holozäne Migrationen der Schmetterlingsarten). Abschließend werden mögliche Gefährdungsursachen diskutiert und notwendige Schutzmaßnahmen abgeleitet.
Tyrphobiontic Butterflies and Moths in Nutrient-Poor Bogs – Parameter-based analysis of the spectrum of species as base for conservation strategies
Climate change increasingly influences habitats of often isolated butterflies and moths in nutrient-poor bogs. The insect species are mainly associated with colder local climates, particular edaphic conditions and a specific plant composition. Therefore it is important to have a detailed knowledge of the most sensible species and their demands. Against this background the paper presented differentiates and describes tyrphobiontic and tyrphophilic species of nutrient-poor bogs based on specific parameters. For this purpose criteria such as larval host plants, distribution type, microclimatic preferences and essential bog structures have been applied. Additionally the paper gives an insight into the post-glacial biogeography of Central Europe, including Pleistocene and Holocene migrations of butterfly species. Finally, the study discusses potential threats are discussed and necessary protection measures.
- Veröffentlicht am
1 Einleitung
Nährstoffarme Moore (syn. Hochmoore, Regenmoore, Torfmoore, Armmoore, ombrotrophe Moore) stellen aufgrund ihres Eigenklimas „Kälteinseln“ in unserer mitteleuropäischen Landschaft dar. So erwärmt sich der Moorkörper aufgrund der geringen Wärmeleitfähigkeit des Torfes und der hohen spezifischen Wärmekapazität des Wassers im Jahresverlauf nur langsam. Da Moore oft eine höhere Verdunstung als ihre Umgebung aufweisen, tritt bei Wind der sogenannte „Oaseneffekt“ ein, d.h. die überströmende Luft wird feuchter und kühler (vgl. Succow & Joosten 2001). Die relativ niedrigen Durchschnittstemperaturen von Mooren haben dazu geführt, dass diese Habitate heute als „Paläorefugien“ für an kältere und extremere Bedingungen angepasste Arten hochbedeutsam sind (vgl. u.a. de Lattin 1967, Sommer et al. 2015). Dieses gilt insbesondere für die feucht- und kaltstenotopen Moorbesiedler, welche aufgrund der prognostizierten und beobachtbaren Temperaturerhöhungen im Zuge des Klimawandels zunehmend „in Bedrängnis“ geraten (Thiele et al. 2013, 2014a).
Neben den klimatischen Entwicklungen verschlechtern die Wirkungen von oft tiefgreifenden Lebensraumdegradationen den Zustand der Biozönosen und begründen eine besondere Sensibilität und Schutzwürdigkeit der an nährstoffarme Moore gebundenen Schmetterlingsarten. Unter den Degradationen sind insbesondere Veränderungen des Landschaftswasserhaushalts, die Entwässerung des Moorkörpers nach Torfabbau und der Gehölzaufwuchs zu nennen.
Um geeignete Maßnahmenstrategien zur Erhaltung der Arten ableiten zu können, ist es zunächst von großer Bedeutung, die „Leitarten“ der nährstoffarmen Moore genau zu kennen. Dazu ist in den letzten 100 Jahren viel geforscht worden (u.a. Bergmann 1951, Brunzel & Bussmann 1994, Burmeister 1990, de Lattin 1967, Gelbrecht 1988, Gelbrecht et al. 2003, Gerstberger 2014, Gräwe et al. 2004, Holdhaus 1912, Peus 1932, Rabeler 1930, Weidlich 1992, Thiele et al. 2004, Thiele et al. 2011).
Standen Anfang des 20. Jahrhunderts v.a. Fragen zur Besiedlung der Moore im Mittelpunkt, so gab es aber auch zahlreiche Ansätze zur Beschreibung der Bindung von Schmetterlingsarten an Moore (u.a. Peus 1932, Rabeler 1930). De Lattin (1967) koppelte dieses umfangreiche Wissen an die glaziale/postglaziale Verbreitungsgeschichte der Tiere (häufig Schmetterlinge). Durch die Entwicklung einer ökologischen Typologie der Moore (Succow & Jeschke 1986, Succow & Joosten 2001) wurde es für die unterschiedlichen Moorökosysteme möglich, Verknüpfungen zwischen abiotischen und biotischen Faktoren sowie den Anspruchskomplexen der Arten herzustellen.
Ziel der vorliegenden parametergestützten Analyse ist es, die Erkenntnisse zu tyrphobionten/tyrphophilen Arten aus der Literatur zusammenzufassen, eine Typisierung anhand von hochmoorspezifischen Merkmalen vorzunehmen und die benannten Arten nach ihrem Grad an Tyrphophilie (Erklärung siehe Textkasten) zu ordnen. Damit wird eine wesentliche Grundlage geschaffen, um später die Reaktionen der Schmetterlingsarten auf den Klimawandel zu prognostizieren und ggf. die Wirkungen mildern zu können.
Definitionen
tyrphobionte Arten (altengl. turf = Torf, griech. bioo–n = lebend): Bezeichnung für Organismen, deren Vorkommen auf Hochmoore beschränkt ist
tyrphophile Arten (altengl. turf = Torf, griech. philos = Freund): Arten, die ihr Verbreitungsoptimum im Hochmoor haben, aber auch andere Lebensräume besiedeln
(Quelle: http://www.spektrum.de/lexikon/biologie )
2 Methode
Im ersten Schritt wurde die historische und aktuelle Literatur zum Grad der Bindung von „Großschmetterlingsarten“ an typische Lebensräume in Hoch- und Zwischenmooren analysiert. In die Analyse sind Erkenntnisse u.a. aus folgender Literatur eingeflossen: Bergmann 1951, Biota 1996 und 1997, Burmeister 1990, de Lattin 1967, Deutschmann 1988 und 1999, Gelbrecht 1988, Gelbrecht et al. 2003, Gerstberger 2014, Gräwe et al. 2004, Peus 1932, Rabeler 1930, Thiele & Berlin 1999 und 2002, Thiele et al. 2004, 2011 und 2014b, Weidlich 1992).
Es konnte ein Datensatz von 24 potentiell tyrphobionten/tyrphophilen Arten zusammengestellt werden. Danach sind Merkmale definiert worden, die eine Typisierung der Arten zuließen. Diese können unter folgenden Parametern zusammengefasst werden:
Verbreitungsgeschichte der Arten;
Ansprüche an Habitate (z.B. Fraßpflanzenpräferenzen, Bindung an Pflanzenvergesellschaftungen);
Ansprüche an das Klima (kann hier nur untergeordnet und für einige Arten behandelt werden);
Ansprüche im Moor (z.B. Besiedlung spezifischer Zonen und Strukturen).
Gestützt auf Literaturangaben (u.a. Ebert 1991-2001, Koch 1991, Tolman & Lewington 1998, Weidemann 1995) und die Parameter wurde eine Typisierung durchgeführt. Im Ergebnis konnten die Schmetterlingsarten abgeschieden werden, die eng an nährstoffarme Moore gebunden sind. Damit sind die klimasensibelsten Arten herausgefiltert worden. Unter Einbeziehung der aut- und synökologischen Anspruchskomplexe dieser Taxa werden konkrete Gefährdungsursachen diskutiert und erste Ansätze für Schutzstrategien abgeleitet.
3 Ableitung der Merkmale zur Bewertung des Grades an Tyrphophilie
3.1 Holozäne Verbreitungsgeschichte der Arten
Mit der quartären Eiszeit vor 2,6 Mio. Jahren begann auf der nördlichen Halbkugel ein Zeitalter, in dem die Vergletscherungen der Kontinente deutlich zunahmen (Kahlke 1981). Damit starb auch ein großer Teil der artenreichen Fauna des Neogens (v.a. des Miozäns) aus oder wurde in Refugialräume gedrängt. Für die Schmetterlinge gibt es nur wenige direkte Hinweise auf glaziale und postglaziale Wanderungsbewegungen, es lassen sich aber aus der Struktur und Lage klimatisch geeigneter Lebensraume indirekt Erkenntnisse dazu gewinnen. Für mitteleuropäische Arten lagen solche Räume vornehmlich im amurisch-sibirischen, mediterranen oder pannonisch-pontischen Bereich.
Auf dem Höhepunkt der pleistozänen Vereisung gab es in Europa einen noch ca. 300km breiten eisfreien Streifen zwischen den skandinavischen und Alpengletschern. Die dort existierende Frostschutt-Tundra war von einer glazialen Mischfauna bevölkert, die aus dem Norden und den Alpen stammte (v.a. arktoalpine Taxa). Im letzten glazialen Maximum vor 21000 Jahren herrschten hier Bedingungen, wie wir sie heute noch beispielsweise aus den Permafrostgebieten im Norden Skandinaviens kennen (Lang 1994, Lowe & Walker 1997).
Dennoch wird davon ausgegangen, dass auch Insekten die Möglichkeit hatten, periglazial zu überdauern. Für Köcherfliegen und Libellenarten ist das belegt (vgl. Brockhaus 2012, Malicky 1990), aber auch Schmetterlinge dürften in eisfreien Gebieten hinreichende Existenzbedingungen vorgefunden haben (Layberry et al. 2001, Scott 1986). So kam es in den kurzen Sommern, bedingt durch den hohen Sonnenstand, zur stärkeren Erwärmung der Tundrenböden. Das führte beispielsweise zur Ausbildung einer an Zwergsträuchern, Kräutern und Gräsern reichen Tundra mit Steppenelementen (Kahlke 1981, Willerslev et al. 2014). Damit dürften Nektarquellen und Fraßpflanzen für kälteangepasste Lepidopteren vorhanden gewesen sein. Zudem wurden die Kaltzeiten (Glaziale) selbst auch immer wieder durch relativ warme „Interstadiale“ unterbrochen.
Zu klären bleibt die Frage, wie die Schmetterlinge in den kurzen Sommern die Larvalentwicklung abschlossen und wie sie den langen Winter überdauerten. Die Antwort findet sich bei Betrachtung der rezenten Fauna Grönlands. 52 Arten überstehen in der Arktis das harsche Klima, benötigen aber mehrere Jahre, um die Larvalphase zu beenden (Thiele 2013, Wolff 1964). So können beispielsweise die stark behaarten Larven von Gynaephora groenlandica (Lymantriidae) wenigstens 13 Jahre leben und dabei das sich immer wiederholende Durchfrieren und Tauen tolerieren (Kukal et al. 1988, Kukal & Dawson 1989).
Viele der zur glazialen Fauna gehörigen Tierarten (arktoalpiner Verbreitungstyp) zogen sich mit Abtauen des Eises nach Norden (zumeist Skandinavien, vgl. Berlin & Thiele 2012, Thiele & Thiele 2011) bzw. Süden (Alpen) zurück. Mit den sich verbessernden Klimabedingungen breiteten sich Schmetterlingsarten der verschiedenen Refugialräume wieder aus, so dass eine Mischfauna entstand. Arten des amurisch-sibirischen Refugialraumes bildeten dabei die Mehrzahl der in Mitteleuropa eingewanderten Taxa (de Lattin 1967).
Mit einsetzender Bewaldung des Kontinents drangen sibirische, boreoalpine Faunenelemente in Richtung Westen vor. Diese waren an ein kontinentales Klima angepasst und dürften im Präboreal/Boreal die westlichste Ausdehnung gehabt haben. Mit dem zunehmend atlantischen Charakter des Klimas (Atlantikum, Bildung der nährstoffarmen Moore) wurden sie wieder nach Osten zurückgedrängt und hinterließen in „günstigen“ Lagen Reliktvorkommen. Die „Kälteinseln“ der nährstoffarmen Moore waren solche Bereiche, in denen sich die Arten disjunkt ansiedeln konnten. Es handelte sich bei diesem Vorgang somit nicht um eine arktoalpine, sondern um eine boreoalpine Disjunktion von arborealen (Wald-)Arten (de Lattin 1967).
Zu den enger an nährstoffarme Moore gebundenen Arten gehören somit Schmetterlinge des boreomontanen/boreoalpinen oder eurosibirischen/euroasiatischen Verbreitungstyps. Stellt erstgenannte Gruppe zumeist die tyrphobionten Arten, finden sich im letztgenannten Verbreitungstyp vielfach die tyrphophilen Arten wieder.
3.2 Ansprüche an Habitate und Klima
Wesentlich für das Vorkommen von stenotop angepassten Schmetterlingsarten der Armmoore ist das Vorhandensein bestimmter moortypischer Pflanzenvergesellschaftungen. Dazu gehören beispielsweise der Zwergstrauch-Torfmoosrasen (Oxycocco-Sphagnetea) mit Moosbeere, Rosmarinheide, Wollgräsern und Seggen sowie verheidete Stadien mit Besen- und Glockenheide. Die Phytozönose ist insgesamt in diesen Bereichen sehr artenarm und spezialisiert. In den angrenzenden Kiefern- oder Moorbirkenwäldern stehen zumeist Sumpfporst, Moor-Heidelbeere und im Küstenbereich der Gagelstrauch.
Wird es nährstoffreicher (mesotroph-saure Moore), so spielen die Torfmoos-Seggenriede (Sphagno-Caricetalia) mit Wollgräsern und verschiedenen Seggenarten eine größere Rolle (vgl. Gelbrecht et al. 2003). Auf Grund der nicht mehr so extremen Bedingungen kommen zahlreiche weitere Pflanzen- und auch Schmetterlingsarten hinzu.
Entsprechend ihres boreoalpinen bis boreomontanen Verbreitungstyps (nordisch/alpin bzw. nordisch; vgl. u.a. Peus 1932) sind die Schmetterlinge nährstoffarmer Moore an Gebiete mit kühlerem Eigenklima (kontinentaler) und an das Vorhandensein von Pflanzen gebunden, die heute noch im borealen bis subarktischen Gürtel der Erde gefunden werden. Schaut man sich das Fraßpflanzenspektrum von tyrphobionten Schmetterlingsarten der Arm- und Zwischenmoore an, so werden zumeist Pflanzen wie Wollgräser, Preiselbeere, Moor-Heidelbeere, Moosbeere, Heidekraut und Sumpf-Porst in der Literatur genannt.
Worin liegt nun die Spezifität des Eigenklimas von nährstoffarmen Mooren? Es weist große Temperaturunterschiede zwischen Tag und Nacht auf und kann als „kontinentaler“ bezeichnet werden (vgl. Gelbrecht 1988). Das Frühjahr kommt im Moor langsam und spät, zumal der Moorkörper im Winter mitunter tiefgründig durchfriert. Der höhere Sonnenstand zeigt in dieser Periode somit nur wenig Wirkung und der Beginn der Vegetationsperiode verzögert sich stark. Im Sommer können sehr hohe Lufttemperaturen über dem dunklen Torf auftreten. Die Tageserwärmung drückt sich jedoch nur in oberflächennahen Schichten des Moorkörpers aus (Maier et al. 1985). Unter diesen Schichten sinken die Temperaturen wegen der geringen Wärmeleitfähigkeit des Torfes hingegen deutlich ab. Generell ist die potenzielle Verdunstung über nährstoffarmen Mooren hoch (Maier et al. 1985). Nebel ist aufgrund der großen Temperaturunterschiede zwischen Moor und darüber liegender Luft insbesondere in den kalten Jahreszeiten häufig. Damit steigt auch die Feuchtigkeit am Boden und in der unmittelbar darüber liegenden Schicht.
Nach Burmeister (1990) sind für die Ausbildung einer spezifischen Regenmoorflora und -fauna die Extreme im terrestrischen Mikroklima von großer Bedeutung. Die kaltkontinentalen Bedingungen fordern von den Besiedlern eine große Toleranz gegenüber Temperaturschwankungen und eine erhöhte Kälteresistenz.
Neben dem Eigenklima spielt das Mikroklima in verschiedenen Bereichen des Moores eine große Rolle. In den Schlenken herrschen eine hohe Luftfeuchtigkeit und ein ausgeglichenes Mikroklima vor. Hingegen ist es im Bultenbereich vergleichsweise trockener und es besteht durch die Exposition ein Extremklima. Tyrphobionte Arten benötigen vielfach beide Bereiche innerhalb ihrer metamorphotischen Entwicklung. Zudem halten diese Extreme Sekundärbesiedler als Konkurrenten in Grenzen.
Die an nährstoffarme Moore gebundenen Schmetterlingsarten sind an das Vorhandensein von Fraßpflanzen gebunden, die heute v.a. im borealen bis subarktischen Gürtel der Erde zu finden sind. Bestimmte Pflanzenvergesellschaftungen (u.a. Zwergstrauch-Torfmoosrasen) werden im Zusammenhang mit dem Auftreten dieser Arten immer wieder genannt. Außerdem sind sie an Extreme des Eigen- und Mikroklimas der Moore angepasst.
3.3 Ansprüche im Moor
Arm- und Zwischenmoore sind horizontal wie vertikal zoniert (de Lattin 1967, Peus 1932). Sie bestehen zumeist aus einer weitestgehend gehölzfreien Zentralfläche, die vielfach ein ausgeprägtes Bulten- und Schlenkensystem integriert. Einzelne kleinere Gehölzhorste (zumeist Moor-Birke und Kiefer) haben sich aus Samenanflug gebildet. In einigen Mooren existieren „Mooraugen“. An das eigentliche Moor schließt sich peripher das Lagg an, wo sich überschüssiges Wasser sammelt und das meist Reichmoorcharakter trägt. Dahinter stockt vielfach der Moorwald, der in den Wald auf mineralischem Untergrund übergeht. Grundsätzlich gibt es keinen Bestandteil in diesem Ökosystem, in dem man nicht tyrphobionte Schmetterlingsarten finden kann. Da viele aber das Eigenklima des Moores und die daran angepassten Pflanzen benötigen, ist die Konzentration auf der zentralen, gehölzarmen Fläche am größten. Das trifft v.a. auf die schattenfliehenden Arten zu (u.a. Hochmoor-Gelbling Colias palaeno, Hochmoor-Bläuling Vacciniina optilete, Moor-Bunteule Anarta cordigera, vgl. Peus 1932), die eine Baumfreiheit benötigen.
Die tyrphophilen/tyrphobionten Schmetterlingsarten sind innerhalb des Moores vornehmlich auf den offenen Hochmoorflächen und in Ökotonbereichen zu finden. Sie sind vielfach schattenfliehend.
4 Ergebnisse
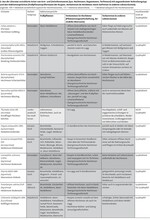
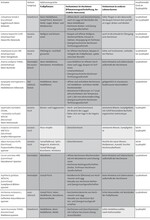
Anhand der erörterten Parametermerkmale konnten in Tab. 1 tyrphobionte und tyrphophile Schmetterlingsarten abgegrenzt werden. Die Ergebnisse beziehen sich dabei hauptsächlich auf die nährstoffarmen Moore der Norddeutschen Tiefebene.
5 Diskussion
5.1 Artenkulisse der tyrphobionten/tyrphophilen Taxa
Von den 24 vorausgewählten Arten konnten im engeren Sinne neun tyrphobionte Taxa abgeschieden werden. Dabei handelt es sich um Hochmoor-Gelbling (Colias palaeno, Abb. 1), Hochmoor-Bläuling (Vacciniina optilete, Abb. 2), Hochmoor-Scheckenfalter (Boloria aquilionaris, Abb. 3), Hochmoor-Bodeneule (Coenophila subrosea), Moor-Bunteule (Anarta cordigera), Heidelbeeren-Silbereule (Syngrapha interrogationis), Moosbeeren-Spanner (Carsia sororiata), Sumpfporst-Blütenspanner (Eupithecia gelidata) und Gefleckten Rauschbeerspanner (Arichanna melanaria, Abb. 4).
Diese Arten gehören zumeist dem boreoalpinen Verbreitungstyp an oder kommen zumindest im nördlichen borealen Gürtel vor. Sie leben auf typischen Fraßpflanzen der nährstoffarmen Moore, treten im Bereich von hochmoortypischen Pflanzenvergesellschaftungen auf und benötigen für ihre Existenz vielfach kühle klimatische Verhältnisse.
Vier Arten wurden als tyrphobiont bis tyrphophil eingestuft. Sie sind im weiteren Sinne als noch deutlich an das Hochmoor angepasst zu bezeichnen. Das trifft auf die Heidemoor-Bodeneule (Protolampra sobrina), die Gagelstrauch-Moor-Holzeule (Lithophane lamda), die Haworths-Mooreule (Celaena haworthii) und die Moor-Stengeleule (Amphipoea lucens) zu.
Weitere zehn Taxa sind unterschiedlich tyrphophil und treten als mehr oder weniger stete Begleiter auf (vgl. Tab. 1). Bezüglich dieser Arten ist die Liste keinesfalls vollständig und kann gerade bei Taxa mit niedrigen Graden an Tyrphophilie deutlich erweitert werden. Hinzu kommt noch eine Art, die vornehmlich als Sekundärbesiedler aus dem Umland betrachtet werden kann (Rundflügel-Flechtenbärchen, Thumata senex).
Es sei an dieser Stelle angemerkt, dass in der vorliegenden Analyse Einiges fragmentarisch bleiben muss, da vielfach Grundlagenkenntnisse zu speziellen autökologischen Ansprüchen der Schmetterlingsarten (z.B. Bindung an Mikroklima) noch nicht bekannt sind.
5.2 Gefährdungsursachen
Die anthropogen bedingten Ursachen für die Gefährdung tyrphobionter (und tyrphophiler) Schmetterlinge sind in vielen Fällen ähnlich. Sie reichen von der lokalen Nutzung der Moore zum Torfabbau, über die Entwässerung bis hin zur großflächigen Störung des Landschaftswasserhaushalts. All dieses beeinflusst zumeist die Höhe und natürliche Dynamik des Moorwasserspiegels negativ. Ein nachfolgendes Aufwachsen von Wald forciert die Verdunstung und zerstört vielfach
sowohl die notwendigen Mikroklimate
als auch die hochmoortypischen (Offenland-) Strukturen.
Wegen ihrer spezifischen Ansprüche sind die stenotopen Arten aber eng an bestimmte abiotische und biotische Faktorenkomplexe gebunden. Migrationen über die Grenzen der Moore hinaus kommen eher selten vor und können meist auf Verdriftungen zurückgeführt werden. Damit ist mit einem aktiven Zuzug aus anderen Mooren bei sinkender Populationsgröße nicht zu rechnen. Auch Wiederansiedlungen haben wenig Aussicht auf Erfolg.
Eine weitere Gefährdungsursache für die hochmoortypischen Schmetterlinge stellt der Klimawandel dar. Der Zwischenstaatliche Ausschuss für Klimaänderung (IPCC) sieht die derzeitige Erwärmung des Klimasystems als gegeben an. So war seit 1850 jedes der letzten drei Jahrzehnte sukzessive wärmer als alle vorangehenden. Der menschliche Einfluss fand dabei insbesondere „in der Erwärmung der Atmosphäre und des Ozeans, in Veränderungen des globalen Wasserkreislaufs, in der Abnahme von Schnee und Eis, im Anstieg des mittleren globalen Meeresspiegels und in Veränderungen einiger Klimaextreme“ seinen Niederschlag (IPCC 2013). Es ist wahrscheinlich, dass die Änderung der globalen Erdoberflächentemperatur am Ende des 21. Jahrhunderts, bezogen auf die Periode 1850–1900, mehr als 1,5°C beträgt. Dabei wird es regionale Unterschiede geben und die mittlere Erwärmung über Land größer sein als über dem Meer. Über den meisten Landflächen ist auf der täglichen und jahreszeitlichen Zeitskala mit häufigeren heißen und weniger kalten Temperaturextremen zu rechnen (IPCC 2013).
Für die an kühlere Verhältnisse in Mooren angepassten und zudem noch relativ standortgebundenen tyrphobionten/tyrphophilen Arten bringt der Klimawandel besondere Probleme mit sich. Sie müssen im Ökosystem verbleiben, das dann klimatische Verhältnisse aufweisen kann, die zumindest in Teilen die Existenz dieser Arten bedrohen. Die Gefahr des lokalen Aussterbens dieser Taxa ist somit real gegeben.
5.3 Ableitung von Schutzmaßnahmen
Wie viele andere Bundesländer fördert auch Mecklenburg-Vorpommern seit den 1990er-Jahren die Revitalisierung und die Erhaltung der Moore (Moorschutzprogramm). Für die Bestimmung der ökologischen Renaturierungsziele und der Artenschutzmaßnahmen ist es dabei von großer Bedeutung, die streng angepassten tyrphobionten/tyrphophilen Taxa zu kennen. Damit können ihre aut- und synökologischen Anspruchskomplexe in den Prozess der Maßnahmenfindung gezielt einfließen. Diese Arten sind quasi die Indikatoren für den Zustand der Biozönose, d.h. gelingt es, die weitgehend isolierten Populationen zu erhalten, wird sich das auch positiv auf andere Moorarten auswirken.
Der Effekt von klimatischen Änderungen kann nur abgemildert werden, wenn
zum einen die Habitatbedingungen (z.B. Strukturen, Wasserhaushalt, Fraßpflanzen) günstig sind und
zum anderen, wenn es dadurch gelingt, Zeit für die Anpassung der stenotopen Taxa an das veränderte Klima zu gewinnen.
Vor diesem Hintergrund ist es auch wichtig, die klimatischen Veränderungen der artspezifischen Lebensräume und ihre Wirkungen auf die Individuen genauer zu kennen. Dazu muss zunächst untersucht werden, welche klimatischen Faktoren (z.B. Temperatur, Feuchte, Extremereignisse) für die Schmetterlingsfauna in nährstoffarmen Mooren zukünftig begrenzend wirken. Im nächsten Schritt können daraus ganzheitliche Schutzstrategien abgeleitet werden, die nicht nur die Beseitigung struktureller Lebensraumdegradationen, sondern auch das sich verändernde Klima einbeziehen.
Literatur
Bergmann, A. (1951): Die Großschmetterlinge Mitteldeutschlands. Band 1. Urania, Jena.
Berlin, A., Thiele, V. (2012): Ephemeroptera, Plecoptera, und Trichoptera Mecklenburg-Vorpommerns. Verbreitung, Gefährdung, Bioindikation. Steffen, Friedland.
Biota (1996): Erarbeitung eines landesweit gültigen Bewertungsverfahrens für Hochmoore auf der Basis zoologischer Taxa“. 1. Teil. Ministerium für Landwirtschaft und Naturschutz des Landes Mecklenburg-Vorpommern, Schwerin.
– (1997): Erarbeitung eines landesweit gültigen Bewertungsverfahrens für Hochmoore auf der Basis zoologischer Taxa“. 2. Teil. Ministerium für Landwirtschaft und Naturschutz des Landes Mecklenburg-Vorpommern, Schwerin.
Brockhaus, T. (2012): Wie kam Somatochlora alpestris (SELYS) in die zentraleuropäischen Gebirge? Der Lebensraumwechsel einer stenothermen transpaläarktisch verbreiteten Kaltzeitart am Beispiel des Erzgebirges (Sachsen) (Odonata, Anisoptera, Corduliidae). Entomol. Nachr. Ber. 65, 17-28.
Brunzel, S., Bussmann, M. (1994): Der Hochmoor-Perlmutterfalter Boloria aquilionaris (Stichel, 1908) (Lep.: Nymphalidae) in den Mooren des Ebbegebirges (Märkischer Kreis, NRW). Entomol. Nachr. Ber. 39, 73-79.
Burmeister, E.-G. (1990): Die Tierwelt der Moore (speziell der Regenmoore). In: Göttlich, K., Hrsg., Moor- und Torfkunde, E. Schweizerbart’ sche Verlagsbuchhandlung, Stuttgart, 29-47.
de Lattin, G. (1967): Grundriss der Zoogeographie. Gustav Fischer, Stuttgart.
Deutschmann, U. (1988): Die Lepidopterenfauna des „NSG Gambower Moor“ und seiner Randgebiete. In: Kiesewetter, H., Labes, R., Hrsg., Das Naturschutzgebiet Grambower Moor, Eigenverlag, Schwerin.
– (1999): Die Lepidopterenfauna des „NSG Gambower Moor“ und seiner Randgebiete in Nordwestmecklenburg. Virgo 3, 59-81.
Ebert, G. (1991-2001): Die Schmetterlinge Baden Württembergs. Bd. 1-8. Eugen Ulmer, Stuttgart.
Gelbrecht, J. (1988): Zur Schmetterlingsfauna von Hochmooren der DDR. Entomol. Nachr. Ber. 32, 49-56.
–, Kallies, A., Gerstberger, M., Dommain, R., Görtz, U., Hoppe, H., Richert, A., Rosenbauer, F., Schneider, A., Sobczyk, T., Weidlich, M. (2003): Die aktuelle Verbreitung der Schmetterlinge der nährstoffarmen und sauren Moore des norddeutschen Tieflandes (Lepidoptera). Märkische Ent. Nachr. 5, 1-68.
Gerstberger, M. (2014): Tyrphobionte Schmetterlingsarten oligotroph-saurer Zwischenmoore in Brandenburg. http://www.orion-berlin.de/schmetter/moor.htm.
Gräwe, D., Thiele, V., Rowinsky, V. (2004): Zur Charakterisierung und ökologischen Bewertung des Tessiner Moores bei Karft und Möglichkeiten seiner Sanierung. TELMA 34, 185-195.
Holdhaus, K. (1912): Kritisches Verzeichnis der boreoalpinen Tierformen (Glazialrelikte) der mittel- und südeuropäischen Hochgebirge. Annalen des Naturhistorischen Museums in Wien 26, 399-440.
IPCC (2013): Zusammenfassung für politische Entscheidungsträger. In: Stocker, T.F., Quin, D., Plattner, G.-K., Tignor, M., Allen, S.K., Boschung, J., Nauels, A., Xia, Y., Bex, V., Midgley, P.M., Hrsg., Klimawandel 2013: Wissenschaftliche Grundlagen, Beitrag der Arbeitsgruppe I zum Fünften Sachstandsbericht des Zwischenstaatlichen Ausschusses für Klimaänderung, Cambridge University Press, Cambridge (UK), New York (USA).
Kahlke, H. D. (1981): Das Eiszeitalter. Urania, Leipzig, Jena, Berlin.
Koch, M. (1991): Wir bestimmen Schmetterlinge. Ausgabe in einem Band, bearbeitet von W. Heinicke. Neumann, Leipzig, Radebeul, 792S.
Kukal, O., Dawson, T.E. (1989): Temperature and food quality influences feeding behavior assimilation efficiency and growth rate of the arctic woody-bear caterpillars. Oecologica 79, 526-532.
–, Heinrich, B., Duman, J.G. (1988): Behavioural thermoregulation in the freeze-tolerant arctic caterpillar, Gynaephora groenlandica. Journal Experimental Biology 138, 181-193.
Lang, G. (1994): Quartäre Vegetationsgeschichte Europas. Methoden und Ergebnisse. Gustav Fischer, Jena, Stuttgart, New York.
Layberry, R.A., Hall, P.W., Lafontaine, J.D. (2001): The Butterflies of Canada. University of Toronto Press Inc., Toronto, Buffalo, London.
Lowe, J.J., Walker, M.J.C. (1997): Reconstructing Quartenary Environments. Prentice Hall Harlow, England, Second Edition.
Malicky, H. (1990): Spuren der Eiszeit in der Trichopterenfauna Europas. Revista di Idrobiologia 27, 247-297.
Maier, R., Punz, W., Domschitz, E., Nagl, A., Neumann, G., Plefka, E., Teuschl, G., Korner, I., Hammer, O., Hudler, P. (1985): Beiträge zur Ökophysiologie von Betula nana auf einem Hochmoor im Lungau (Salzburg). Vorh. Zool. Bot. Ges. Österreich 123, 151-174.
Peus, F. (1932): Die Tierwelt der Moore unter besonderer Berücksichtigung der europäischen Regenmoore. Handbuch der Moorkunde, 3. Bd., Borntraeger, Berlin.
Rabeler, W. (1930): Die Fauna des Göldenitzer Regenmoores in Mecklenburg (Mollusca, Isopoda, Arachnoidea, Myriapoda, Insecta). Z. f. Morphol. u. Ökol. d. Tiere 21, 172-315.
Scott, J.A. (1986): The Butterflies of North America. A Natural History and Field Guide. Stanford University Press, Stanford, California.
Sommer, R., Thiele, V., Seppä, H. (2015): Use and misuse of the term “glacial relicts” in the Central European biogeography and Conservation ecology of insects. Insect Conservation and Diversity, DOI: 10.1111/icad.12109.
Succow, M., Jeschke, L. (1986): Moore in der Landschaft: Entstehung, Haushalt, Lebewelt, Verbreitung, Nutzung. Urania, Leipzig, Jena, Berlin.
Succow, M., Joosten, H. (2001): Landschaftsökologische Moorkunde. E. Schweitzenbart‘sche Verlagsbuchhandlung, Stuttgart.
Thiele, V. (2013): Zur Kenntnis der Schmetterlinge Grönlands und ihrer Biologie. Virgo 16 (1), 9-15.
–, Berlin, A. (1999): Regenmoorbewertung im Grambower Moor – ein neues bioindikatives Verfahren wird entwickelt. In: Förderverein Grambower Moor e.V., Hrsg., Renaturierung des Grambower Moores, 38-45.
–, Berlin, A. (2002): Zur ökologischen Bewertung des Naturschutzgebietes „Großes Moor bei Darze“ (Mecklenburg-Vorpommern) mittels eines neu entwickelten Verfahrens auf Basis zoologischer Taxa. TELMA 32, 141-159.
–, Berlin, A., Blumrich, B., Höhlein, V. (2004): Lepidopteren- und Trichopterenzoozönosen des Naturschutzgebietes „Rugenseemoor“ (Mecklenburg-Vorpommern) und ihre Bedeutung als typspezifisches Leitbild. TELMA 34, 155-171.
–, Berlin, A., Blumrich, B., Bringmann, H.-D., Gottschalk, H.-J., Beckmann, H., Eitner, M., Wolf, F. (2014b): Zur Kenntnis ausgewählter Gruppen der Insekten im Kesselmoor des Naturschutzgebietes „Schlichtes Moor“ (Mecklenburg-Vorpommern). TELMA (eingereicht).
–, Luttmann, A., Liebe Edle von Kreutzner, K., Degen, B., Berlin, A., Lipinski, A., Niederstrasser, J., Koch, R., von dem Bussche, J. (2013) Durchführung einer Untersuchung zu den Folgen des Klimawandels in Sachsen-Anhalt. Wirkungen des Klimawandels auf europäisch geschützte Arten und Lebensräume. Berichte des Landesamtes für Umweltschutz Sachsen-Anhalt 6, 231 S. und div. Anh.
–, Luttmann, A., Hoffmann, T., Röper, C. (2014a): Ökologische Auswirkungen von Klimaänderungen und Maßnahmenstrategien für europäisch geschützte Arten. Fallstudie zweier FFH-Gebiete in Sachsen-Anhalt. Naturschutz und Landschaftsplanung 46 (6), 169-176.
–, Thiele, M. (2011): Beitrag zur Kenntnis der Schmetterlingsfauna Neufundlands (Provinz Neufundland und Labrador, Nordamerika). Virgo 14, 42-54.
–, Precker, A., Berlin, A., Blumrich, B. (2011): Biozönotische Analyse des „Teufelsmoores bei Gresenhorst“ (Mecklenburg-Vorpommern) mittels der Lepidopteren und aquatischer Insekten. TELMA 41, 101-124.
Tolman, T., Lewington, R. (1998): Die Tagfalter Europas und Nordafrikas. Kosmos, Stuttgart, 319S.
Weidemann, H. J. (1995): Tagfalter beobachten, bestimmen. Naturbuch, Augsburg, 659S.
Weidlich, M. (1992): Der Kenntnisstand über die Verbreitung von Herminia humidalis (Doubleday, 1850) (= Schrankia turfosalis Wocke, 1850) in den ostdeutschen Ländern (Lepidoptera, Noctuidae). Entomol. Nachr. Ber. 36, 29-36.
Willerslev, E., Davison, J., Moora, M., Zobel, M., Coissac, E. et al. (2014): Fifty thousand years of Arctic vegetation and megafaunal diet. Nature 506, 47-51.
Wolff, N. L. (1964): The Lepidoptera of Greenland. The Danish Zoogeographical Investigations in Greenland. C.A. Reitzels Forlag, København.
Anschriften der Verfasser(innen): Dr. Volker Thiele, Dipl.-Geogr. Anne Luttmann, biota – Institut für ökologische Forschung und Planung GmbH, Nebelring 15, D-18246 Bützow, E-Mail volker.thiele@institut-biota.de bzw. anne.luttmann@institut-biota.de.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen






Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.