Libellen-Diversität und -Zönosen in mitteleuropäischen Städten
Abstracts
Im Mitteleuropa wurden seit 1986 fast 30 Stadtfaunen zu Libellen veröffentlicht. In den Städten sind mit insgesamt 62 Arten 77 % aller in Deutschland bekannten Arten festgestellt worden. Städte weisen somit eine hohe Libellenartenvielfalt auf. Begründet ist diese hohe Diversität in einer naturräumlich gegebenen großen Strukturvielfalt. Die Urbanisierung führt demgegenüber zu einer Homogenisierung der Fauna. Die untersuchten Stadtfaunen weisen einen signifikant höheren Sörensen-(Ähnlichkeits)-Koeffizienten von 0,75 als Studien aus dem unbebauten Umland (hier 0,71) auf.
Innerhalb der Stadtgrenzen ist ein Urbanitätsgradient zu erkennen. Neben der Gesamtartenzahl nimmt der Anteil der Spezialisten im Vergleich zu den Generalisten vom Umland zur Innenstadt hin deutlich ab. In den Innenstädten sind die Libellenzönosen so rudimentär ausgebildet, dass selbst die ermittelten 21 häufigsten Arten nicht in jeder Stadt ausreichende Habitate vorfinden. Die höchste Artenvielfalt in Städten konnte vor 1975 festgestellt werden, nach einer Abnahme bis in die 1990er Jahre ist nun wieder eine Artzunahme zu verzeichnen. Als Ursache hierfür ist vor allem die Verbesserung der Fließgewässerqualität zu nennen. Rund 37 % der in Deutschland vorkommenden Libellenarten werden als urbanoneutral bis mäßig urbanophil eingestuft, 63 % aller Arten kommen nur außerhalb der bebauten Bereiche vor und sind somit als (mäßig) urbanophob zu bezeichnen.
Odonata Diversity and Communities in Central European Cities – A Review
Since 1986 nearly 30 Odonata surveys in cities have been published in Central Europe. 77 % (62 species) of the total Odonata fauna of Germany have been found in cities. This high Odonata species richness can be explained by the structural richness due to the high natural diversity of habitats within the biogeographical regions of the cities. However, increased urbanization leads to homogenization of the Odonata fauna. The Odonata assemblages of the cities are more similar than those of not built-up areas, which was indicated by a significantly higher Sörensen coefficient.
Within the city borders an urban gradient can be observed. To the city centre the total number of species and the proportion of specialists markedly decreases. In the cities’ centers, the Odonata communities only occur rudimentarily, and not even the 21 most frequent species have been found in all cities. The highest species diversity in cities was reported before 1975 with a decreasing trend thereafter. Since the 1990ies the number of species recorded in cities has increased again, probably because of the improvement of the total quality of lotic waters. Approximately 37 % of the total Odonata fauna of Germany can be classified as “urbano-neutral” to moderately “urbano-philous”. Correspondingly, 63 % of all species are restricted to non-sealed areas and can be classified as (moderately) urbanophobe.
- Veröffentlicht am
1 Einleitung
Der Erhalt und die Förderung der Artenvielfalt ist weltweit spätestens seit der Verabschiedung des Übereinkommens über die biologische Vielfalt in Rio de Janeiro 1992 das zentrale Thema des Naturschutzes (Heywood 1995). Das Ziel, den Artenrückgang bis 2010 zu stoppen, ist bisher nicht erreicht worden (Butchart et al. 2010, Piechocki et al. 2010). Neben der Eutrophierung, dem Klimawandel und der Ausbreitung invasiver Arten wird die Urbanisierung weltweit als eine der Hauptursachen für die Gefährdung der biologischen Vielfalt angesehen (Hahs et al. 2009, McKinney 2002, Olden et al. 2006).
Für Mitteleuropa liegen seit den 1980er Jahren Untersuchungen über den Einfluss städtischer Siedlungen auf Arten und Lebensräume vor (Sukopp & Werner 1982, Werner & Zahner 2009). Bei den meisten Taxa weisen Städte besonders hohe Artenzahlen auf (Crooks et al. 2004, Kühn et al. 2004, McKinney 2006). Entsprechend bezeichnet Reichholf (2007: 7) Städte als „Inseln der Vielfalt“. Für verschiedene Tiergruppen (z.B. Vögel, Tagfalter und Laufkäfer) wurden Urbanitätsgradienten mit einer vom Stadtzentrum zum Umland steigenden Artenzahl ermittelt (McDonnell & Hahs 2008). In den meisten Studien über Pflanzenarten erreichte der Artenreichtum sein Maximum an den Stadträndern (McKinney 2008). Die Mehrzahl der stadtökologischen Studien beschäftigte sich mit terrestrischen Habitaten und Landlebewesen. Analysen zur Auswirkung von Städten auf semi-aquatische Organismen sind dagegen selten (Urban et al. 2006, Vermonden et al. 2009).
Studien zum Vorkommen von Libellen in Städten liegen aus ganz Mitteleuropa vor (u.a. Saarbrücken: Handke et al. 1986, Bayreuth: Schlumprecht & Stubert 1989, Bremen: Breuer et al. 1991, Kaiserslautern: Ott 1993, Linz: Laister 1995, Ludwigshafen: Ott 1995, Münster: Artmeyer et al. 2000, Salzburg: Schwarz-Waubke & Schwarz 1995, München: Bräu et al. 2001, Hagen: Schlüpmann 2001, Magdeburg: Steglich & Gentz 2002, Mainz: Willigalla 2007, Basel: Küry & Christ 2010). Allerdings beschränkten sich die meisten Arbeiten auf das Auflisten der nachgewiesenen Arten. Aufgrund des Habitat- und Artenreichtums wurden zudem vornehmlich die Stadtrandbereiche untersucht. Der Einfluss von für Städte typischen Umweltbedingungen auf die Artengruppe wurde bislang kaum berücksichtigt.
Ziele dieser Arbeit sollten folgende sein:
(1) Die einzelnen Libellen-Stadtfaunen in Mitteleuropa sollten gesichtet, zusammenfassend analysiert und die Bedeutung von Städten für die Libellen-Artenvielfalt dargestellt werden. Für die Artengruppe wichtige Habitattypen oder Zonen innerhalb der Städte sollten ermittelt werden.
(2) Weiterhin sollten typische Artengemeinschaften abgegrenzt werden.
(3) Anhand von Gemeinsamkeiten oder Unterschieden der einzelnen Stadtfaunen sollte herausgestellt werden, welchen Einfluss die Urbanisierung auf die Libellenfauna hat.
2 Methode
2.1 Datengrundlage
Zunächst erfolgte eine Literaturrecherche. Wir werteten die Datenbank „Odonata“ der Firma ÖSTLAP (Stand 15.05.2009), die Dokumentation Natur und Landschaft online (Abfrage 26.02.2010) sowie das ISI Web of Science (Abfrage 26.02.2010) aus. Als Schlagworte wurden „Stadt“ („city“), „urban“ („urban“) und „Libellen“ („Odonata“) verwendet. Insgesamt konnten 214 Publikationen ermittelt werden.
In die Auswertung nahmen wir alle Arbeiten auf, die folgende Kriterien erfüllten:
flächendeckende Kartierung des gesamten Gebietes,
Größe des Gebietes mindestens 20 km²,
Bearbeitungszeitraum mindestens zwei Jahre oder Anzahl der Untersuchungsstandorte >10,
Bearbeitungsgebiet Mitteleuropa und
Liste der vorkommenden Arten.
Zu einigen Städten lagen mehrere Arbeiten vor, so dass die Gesamtartenliste aus allen verfügbaren Arbeiten zusammengestellt wurde. Zusätzlich recherchierten wir Artikel, die die Libellenfauna ausgewählter, möglichst gleich großer unbebauter Landschaften behandelten (Schlagworte „Natur*“ [„nature*“] und „Libellen“ [„Odonata“], insgesamt 181 Treffer). Neben publizierten Artikeln sichteten wir auch unveröffentlichte Diplomarbeiten. In die Auswertung wurden alle Arbeiten aufgenommen, die oben genannte Kriterien erfüllten.
2.2 Statistische Auswertung
Zum Vergleich der Faunenlisten wurden α-, β- und γ-Diversität ermittelt. Dabei stellt
α-Diversität die Anzahl an Arten innerhalb eines Habitates (hier Gewässers),
β-Diversität die Beziehungen der Artenzusammensetzungen zwischen mehreren Lebensräumen und
γ-Diversität die Anzahl von Arten in einem Lebensraum (hier Stadtzonen bzw. Städte) dar (Werner & Zahner 2009).
Als Maß für die Ähnlichkeit der Libellenzönosen diente der Sörensen-Koeffizient (SK) (Sörensen 1948). Der SK wird auf Grundlage von Präsenz-Absenz-Daten errechnet und kann einen Wert zwischen 0 und 1 annehmen. Je größer der Wert ist, desto ähnlicher sind sich die Zönosen. Die Formel lautet: 2a/(2a+b+c), wobei a die Anzahl der in beiden Proben gemeinsamen Arten ist, b die Anzahl der Arten, die in Probe 1 zusätzlich nachgewiesen wurden und c die Anzahl der Arten, die in Probe 2 zusätzlich nachgewiesen wurden. Der SK wurde verwendet, da er zum einen sehr leicht und nachvollziehbar anzuwenden ist. Zum anderen wird das Vorkommen gemeinsamer Arten durch den Faktor 2 stärker berücksichtigt als das Fehlen einer Art. Denn ein Fehlen einer Art kann sowohl bedeuten, dass sie aufgrund fehlender Habitatstrukturen das Gewässer nicht besiedelt, als auch, dass sie aufgrund von Barrieren oder ähnlichem es bisher nicht geschafft hat, das Gewässer zu besiedeln.
Für normal verteilte Daten (Kolmogrov-Smirnov-Test) erfolgte der Vergleich von Mittelwerten mittels T-Test bzw. ANOVA (Irrtumswahrscheinlichkeit α<5 %). Für nicht normalverteilte Daten wurde der Kruskal-Wallis-H-Test (KWT) bzw. der Mann-Whitney-U-Test (MWU) durchgeführt. Sämtliche statistischen Berechnungen erfolgten mit dem Programm SigmaPlot 11.
Bei allen statistischen Analysen betrachteten wir nur die bodenständigen Arten. Als bodenständig galt eine Art, wenn dies entweder aus der jeweiligen Studie klar abzuleiten war oder aber mindestens drei Nachweise von verschiedenen Fundorten innerhalb des Untersuchungsgebietes vorlagen und gleichzeitig geeignete Reproduktionshabitate für die Art vorhanden waren.
2.3 Stadtzonen
Weiterhin sollte die Besiedlung unterschiedlicher Stadtzonen durch die Libellenfauna untersucht werden. Dazu waren fundpunktgenaue Artenlisten nötig. Diese konnten für 493 Fundpunkte der Städte Erfurt, Gera, Kaiserslautern, Köln, Magdeburg, Mainz und Münster ermittelt werden. Für folgende Stadtzonen erfolgte eine Zuordnung der Fundpunkte (vgl. auch McKinney 2002):
Umland: Gebiete, in denen noch einige Elemente und wesentliche Abläufe der Naturlandschaft erhalten sind und die noch nicht gänzlich durch die Urbanisierung überprägt sind. Anteil der Bebauung im Radius von 200m um das Gewässer unter 10 % (n=187).
Stadtrand: Vororte und Stadtrandbereiche, Anteil der Bebauung im Radius von 200m um das Gewässer zwischen 10 und 50 %, überwiegend ein- bis zweigeschossige Bebauung (n=262).
Innenstadt: Charakteristisch sind städtische Habitate wie Parkanlagen, Friedhöfe, Kleingärten, Stadtwälder sowie zahlreiche Kleinstrukturen (Mauern, Pflasterfugen, Altbäume, unversiegelte Wege), vornehmlich mehrstöckige Bebauung, Anteil der Bebauung im Radius von 200m um das Gewässer über 50 % (n=44).
Zusätzlich wurden die Libellenarten in Habitatgeneralisten und -spezialisten eingeteilt. Alle in der Roten Liste Deutschlands (Ott & Piper 1998) als gefährdet oder stärker bedroht geltenden Arten stuften wir als Spezialisten ein, die übrigen Arten als Generalisten.
2.4 Urbanitätsgradient
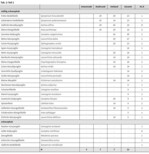
Um einen möglichen Urbanitätsgradienten aufzudecken, wurde die Anzahl bodenständiger Arten pro Gewässer und die Entfernung zur Stadtmitte für die Städte ermittelt, für die vollständige Artenlisten pro Gewässer fundpunktgenau vorlagen (Gera, Kaiserslautern, Köln, Mainz, Münster), einer Regressionsanalyse unterzogen. Als Mittelpunkt der Stadt wählten wir jeweils den Domplatz bzw. das Rathaus. Da Artenzahlen bei Libellen je nach Gewässertyp und -größe stark schwanken, wurden für die Analyse zwei Fälle unterschieden: 1. alle Gewässer, 2. einzelne Gewässertypen (s. Tab. 1; Download im Internet unter http://www.nul-online.de Service - Download ).
2.5 Bindung an Städte (Urbanophilie)
In Anlehnung an Wittig et al. (1985) können Arten in urbanophob (städtische Räume und Habitate meidend), urbanoneutral (Arten, die sowohl in städtischen Räumen als auch in der freien Landschaft vorkommen) und urbanophil (schwerpunktmäßig oder ausschließlich in Städten vorkommend) unterschieden werden.
Auf die Libellen übertragen wurden die Begriffe folgendermaßen definiert:
urbanophob: Arten, die ausschließlich außerhalb menschlicher Siedlungen vorkommen = Arten, die in keiner Stadt nachgewiesen wurden.
mäßig urbanophob: Arten, die vorwiegend außerhalb menschlicher Siedlungen vorkommen = Arten, die nur am stadtnahen Umland nachgewiesen wurden bzw. an den Stadträndern eine Stetigkeit <50 % aufwiesen.
urbanoneutral: Arten, die weder siedlungsnahe noch siedlungsferne Habitate bevorzugen = Arten, die bis in den Innenstadtbereich vorkommen bzw. an den Stadträndern eine Stetigkeit >50 % aufwiesen.
mäßig urbanophil: Arten, die vorwiegend in menschlichen Siedlungen vorkommen = Arten, die in Innenstädten eine Stetigkeit >80 % aufwiesen.
urbanophil: Arten, die an menschliche Siedlungen gebunden sind = Arten, die ausschließlich in der Innenstadt nachgewiesen wurden.
2.6 Libellenzönosen
Für 317 Gewässer lagen vollständige Artenlisten vor. Diese Gewässer wurden anhand der Größe, Wasserführung sowie Art der Entstehung den in Tab. 1 aufgeführten Gewässertypen zugeordnet. Habitatpräferenzen wurden für jede bodenständige Art anhand der Stetigkeit pro Gewässertyp ermittelt. Arten, die nur an einem oder wenigen (maximal drei) Gewässertypen mit mindestens 20 % Stetigkeit vorkamen (30 %, wenn n des Gewässertyps <15) und eine mehr als doppelt so hohe Stetigkeit aufwiesen als an den anderen Gewässertypen, wurden nach Poniatowski & Fartmann (2008) als Leitarten definiert. Arten, die an mehr als drei Gewässertypen eine mehr als doppelt so hohe Stetigkeit aufwiesen als an den anderen Gewässertypen, wurden als Differentialarten bezeichnet. Als Begleiter galten alle Arten, die in vielen Gewässertypen hochstet waren und somit keinen Besiedlungsschwerpunkt haben oder nur geringe Stetigkeiten aufwiesen.
3 Ergebnisse
3.1 Artendiversität
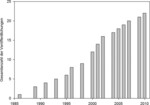
Insgesamt wurden 27 Stadtfaunen analysiert, von denen 22 eine nahezu vollständige Bearbeitung des Stadtgebietes aufwiesen (siehe Abb. 1). Die erste Veröffentlichung stammte aus dem Jahr 1986 (Abb.2). Seither wurde kontinuierlich pro Jahr ca. eine weitere Stadtfauna veröffentlicht.
In den 22 Städten wurden insgesamt 67 Libellenarten festgestellt, 62 davon konnten in mindestens einer Stadt als bodenständig angesehen werden. Von diesen 62 Arten kamen 22 in drei Viertel aller untersuchten Städte vor; elf Arten konnten in jeder Stadt nachgewiesen werden. Von den 22 häufigsten Arten ist eine Art, Gefleckte Heidelibelle (Sympetrum flaveolum), in Deutschland gefährdet, drei weitere Arten, Gebänderte Prachtlibelle (Calopteryx splendens), Großes Granatauge (Erythromma najas) und Falkenlibelle (Cordulia aenea) werden auf der Vorwarnliste geführt. Die übrigen 18 Arten gelten als ungefährdet.
Die Anzahl der Libellenarten pro Stadt lag im Mittel (±SE) bei 37,2±1,7 (Min. 22, Max. 51, n=22), die der bodenständigen Arten bei 32,6±1,4 (Min 22, Max. 43, n=22). Die Artenzahl nahm signifikant mit der Flächengröße der Stadt zu (Abb. 3). Zwischen der Einwohnerzahl (R²=0,31, p=0,178) oder der Anzahl der Probeflächen (R²=0,15, p=0,539) und der Artenzahl bestand kein signifikanter Zusammenhang. Bei den 10 Studien unbebauter Gebiete ergab sich eine etwas niedrigere durchschnittliche Artenzahl von 32,3±2,6 Arten (Quellen: Artmeyer 2000, Bauhus 1996, Göcking 1996, Grüne 1994, Jödicke et al. 1989, Lohr 2007, Muth 1995, Olthoff & Ikemeyer 2001, Schievenhövel & Rödel 2008, Zumbülte 1995). Der Unterschied der Artenzahl zwischen der Libellenfauna von Städten und unbebauten Gebieten war somit nur gering und nicht signifikant (t-Test, t=–0,122, p=0,904).
Der Sörensen-Koeffizient als Maß für die Ähnlichkeit der Libellenfauna der einzelnen Städte lag zwischen 0,55 und 0,88, der Mittelwert beträgt 0,75±0,00. Der SK und die Entfernung der Städte zueinander standen in einem negativen Zusammenhang (R²=–0,30, p<0,001, n=462). Sowohl zwischen Groß- und Kleinstädten (Großstädte Einwohnerzahl >100.000, Kleinstädte Einwohnerzahl <100.00; MWU, U=22260,00, p=0,08) als auch Städten unterschiedlicher geographischer Regionen (KWT, H=2,15, p=0,34) gab es keine signifikanten Unterschiede beim SK.
3.2 Besiedlung der Stadtzonen
In den sieben Städten mit fundpunktgenauen Daten wurden 56 bodenständige Arten nachgewiesen, von denen 43 Arten innerhalb der stärker bebauten Zonen (Stadtrand und Innenstadt) vorkamen. In diesen beiden Zonen wiesen 19 Arten, Gebänderte Prachtlibelle (C. splendens), Hufeisen-Azurjungfer (Coenagrion puella), Gemeine Becherjungfer (Enallagma cyathigerum), Große Pechlibelle (Ischnura elegans), Glänzende Binsenjungfer (Lestes dryas), Gemeine Binsenjungfer (L. sponsa), Gemeine Weidenjungfer (L. viridis), Frühe Adonislibelle (Pyrrhosoma nymphula), Blaue Federlibelle (Platycnemis pennipes), Gemeine Winterlibelle (Sympecma fusca), Blaugrüne Mosaikjungfer (Aeshna cyanea), Herbst-Mosaikjungfer (A. mixta), Große Königslibelle (Anax imperator), Plattbauch (Libellula depressa), Vierfleck (L. quadrimaculata), Großer Blaupfeil (Orthetrum cancellatum), Blutrote Heidelibelle (S. sanguineum), Große Heidelibelle (S. striolatum) und Gemeine Heidelibelle (S. vulgatum) eine Stetigkeit ≥86 % auf. Innerhalb der Innenstadt wurden 21 Arten festgestellt. Von diesen erreichten neun eine Stetigkeit ≥80 %.
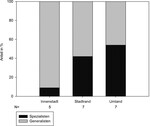
Der Anteil der Spezialisten an der Gesamtfauna lag im Umland bei 54 %, am Stadtrand bei 42 % und in der Innenstadt bei 9 % (Abb. 4).
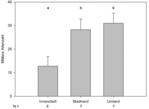
Innerhalb der Innenstadt wurden im Durchschnitt 12,8±1,8 Arten festgestellt, am Stadtrand bereits 28,3±1,7 und im Umland 31,0±2,1 (Abb. 5). Innenstadt und Stadtrand sowie Innenstadt und Umland unterschieden sich signifikant in der Artenzahl, Stadtrand und Umland dagegen nicht. Daher betrachteten wir in einem zweiten Schritt die Artenzahlen getrennt nach Gewässertypen. Signifikante Unterschiede lagen für die Artenzahlen der Teiche zwischen Innenstadt (2,0±0,6) und Stadtrand (7,1±0,6) bzw. Umland (6,0±1,0) vor (KWT, H=19,634, p<0,001; Dunn‘s Posthoc-Test, p<0,05). Die anderen Gewässertypen kamen jeweils nur in zwei Stadtzonen vor. Signifikante Unterschiede in den Artenzahlen bestanden nur zwischen Regenrückhaltebecken der Innenstadt (4,5±1) und des Stadtrandes (7,9±0,6) (T-Test, t=–2,271, p<0,05).
Zwischen den Libellenarten der Innenstadt und des Stadtrandes lag der SK bei 0,54±0,08, für Innenstadt und Umland betrug der Wert 0,49±0,07 und für Stadtrand und Umland 0,82±0,04. Der SK der Arten des Umlandes lag bei 0,75±0,01, der des Stadtrandes bei 0,75±0,02 und der der Innenstadt bei 0,70±0,03. Die β-Diversität unterschied sich nicht signifikant zwischen den einzelnen Zonen (ANOVA, F=2,15, FG=2, p=0,127).
Die Habitatvielfalt unterschied sich zwischen Innenstadt und den beiden anderen Zonen, zwischen Stadtrand und Umland jedoch nicht (Abb. 6). Während in der Innenstadt fünf Gewässertypen vorkamen (im Mittel 2,3±0,6), waren dies am Stadtrand (7,3±0,9) und im Umland (4,7±0,9) insgesamt 14.
3.3 Urbanitätsgradient
Die Analyse der Artenzahl in Zusammenhang mit der Entfernung des Gewässers zum Stadtzentrum zeigte für die berücksichtigten Städte sowohl bei Betrachtung aller Gewässer (Gera: R²=0,061, p=0,08; Kaiserslautern: R²=0,0249, p=0,185; Köln: R²=0,002, p=0,783; Mainz: R²=0,007, p=0,744; Münster: R²=0,02, p=0,689) als auch bei Betrachtung einzelner Gewässertypen (Münster, RRB: R²=0,03, p=0,346; Teiche: R²=0,014, p=0,518; Tümpel: R²=0,102, p=0,287) keinerlei linearen Zusammenhang.
3.4 Bindung an Städte (Urbanophilie)
Von den Libellenarten stuften wir acht Arten [Hufeisen-Azurjungfer (C. puella), Große Pechlibelle (I. elegans), Gemeine Weidenjungfer (L. viridis), Blaugrüne Mosaikjungfer (A. cyanea), Herbst-Mosaikjungfer (A. mixta), Große Königslibelle (A. imperator), Großer Blaupfeil (O. cancellatum), Blutrote Heidelibelle (S. sanguineum)] als urbanophil ein. Sie kamen sowohl in allen Innenstädten als auch in allen weiteren analysierten Städten vor (siehe Tab.2). 22 Arten verhielten sich urbanoneutral. 32 Arten fanden sich nur in den unbebauten Freiflächen des Umlandes der Städte und wurden als mäßig urbanophob bezeichnet. Die fünf in den Städten nicht bodenständig nachgewiesenen Arten verhielten sich urbanophob.
3.5 Libellenzönosen
Als Leitarten der Regenrückhaltebecken der Innenstädte wurden L. viridis, O. cancellatum, S. sanguineum und S. striolatum ermittelt (Tab. 3; Download im Internet unter http://www.nul-online.de Service - Download). A. imperator, A. cyanea und A. mixta waren Leitarten der Abgrabungsgewässer. C. puella war sowohl Leitart der Regenrückhaltebecken als auch der Abgrabungsgewässer. Häufigster Begleiter an allen Gewässertypen war I. elegans.
Da sich hinsichtlich Artenzahlen und Artenspektrum zwischen Stadtrand und Umland keine Unterschiede ergaben, verzichteten wir auf eine Unterscheidung dieser Zonen zur Ermittlung von Libellenzönosen (Tab. 4). Hinsichtlich der Habitatpräferenzen konnten die Arten in drei Gruppen eingeteilt werden. So gab es Arten, die ausschließlich die Fließgewässer besiedelten. Eine zweite Gruppe fand sich nahezu ausschließlich an den Stillgewässern. Die dritte Gruppe besiedelte sowohl Fließ- als auch Stillgewässerhabitate.
Zur Gruppe der Fließgewässerarten zählten Gebänderte Prachtlibelle (C. splendens), Blauflügel-Prachtlibelle (C. virgo), Zweigestreifte Quelljungfer (C. boltonii) und Gemeine Keiljungfer (G. vulgatissimus). Innerhalb dieser Gruppe waren C. virgo und C. splendens Leitarten für die Flüsse und Bäche, C. boltonii für die Bäche und G. vulgatissimus für die Altarme. Die Federlibelle (P. pennipes) wies mit 67 % die höchste Stetigkeit aller Fließgewässerarten auf, war aber auch eine Leitart der Altarme und Seen.
Eine Gruppe von vier Arten [Frühe Adonislibelle (P. nymphula), Blaugrüne Mosaikjungfer (A. cyanea), Blutrote Heidelibelle (S. sanguineum) und Große Heidelibelle (S. striolatum)] wies sowohl an einzelnen Fließ- als auch Stillgewässertypen besonders hohe Stetigkeiten auf. Alle vier Arten wurden als Differenzialarten für Bäche und Gräben bzw. kleinere Stillgewässer eingestuft. Bei den Stillgewässer besiedelnden Arten wurden als Leitarten der Tümpel Glänzende Binsenjungfer (L. dryas) und Südliche Binsenjungfer (L. barbarus) und als Leitart der Regenrückhaltebecken Kleines Granatauge (E. viridulum) ermittelt. Weiterhin konnten Differentialarten abgetrennt werden, die schwerpunktmäßig die größeren Gewässer (Seen und Abgrabungsgewässer) oder die kleineren Gewässer besiedeln. Häufige Begleiter in allen Habitattypen waren Hufeisen-Azurjungfer (C. puella) und Große Pechlibelle (I. elegans). Häufige Begleiter der Stillgewässer waren Glänzende Smaragdlibelle (S. metallica) und Gemeine Heidelibelle (S. vulgatum).
4 Diskussion
4.1 Biodiversität
Viele Autoren bezeichnen Städte als Inseln der Vielfalt (Knapp et al. 2008, Kühn et al. 2004, Reichholf 2007, Wania et al. 2006,). Dies trifft insbesondere auf die Diversität der Gefäßpflanzen zu. Als Handels- und Verkehrsknotenpunkt kommt Städten eine wichtige Rolle als Ausbreitungszentren für durch den Menschen unbeabsichtigt verschleppte Arten zu. Weiterhin führt die Auswilderung von kultivierten (Zier-)Pflanzen zu einer Erhöhung der Artenvielfalt (Kowarik 2003). Auch der größere Temperaturgradient innerhalb einer Stadt im Vergleich zum Umland begünstigt eine große Artenvielfalt (Wohlgemuth 1998). Zudem weisen Städte meist eine reiche Strukturvielfalt auf, die eine hohe Biodiversität bedingt. Die Strukturvielfalt innerhalb von Städten ist häufig bereits naturräumlich gegeben, da Städte zumeist an Naturraumgrenzen oder aber in strukturreichen Regionen gegründet wurden (Kühn et al. 2004, Werner & Zahner 2009). Die Stadt Mainz liegt beispielsweise am Rhein im Übergangsbereich zwischen Rhein-Main-Tiefland und Rheinhessischem Tafel- und Hügelland (LUWG 2007). Braunschweig befindet sich im Schnittpunkt von vier naturräumlichen Einheiten (Suhling et al. 2009).
Städte beherbergen den Großteil der in Deutschland vorkommenden Libellenarten: Von den 81 in Deutschland bekannten Arten wurden 62 (76 %) in mindestens einer Stadt bodenständig festgestellt. Im Durchschnitt ermittelten wir pro Stadt etwa 40 % (33 Arten) der in Deutschland heimischen Arten. Die Artenzahlen variieren allerdings stark zwischen den einzelnen Städten und sind vor allem abhängig von der Flächengröße der Stadt.
Die Zonen mit der höchsten Artenvielfalt innerhalb der Städte sind der Stadtrand sowie das Umland. Die Artenarmut des Stadtzentrums ist vor allem mit dem Mangel an geeigneten Habitaten zu erklären. Zusätzlich verlieren beeinträchtigende Parameter wie Bebauung und Verkehr zum Umland hin ihre Wirkung. Die Erhöhung der Artenvielfalt durch Verschleppung von Libellenarten im bebauten Bereich spielt bisher keine Rolle. Weltweit wurde bislang über die Verschleppung von insgesamt 19 überwiegend asiatischen Libellenarten berichtet (Kipping 2006). Für Deutschland erwähnte Kipping (2006) vier Arten und beschrieb detailliert, wie die Arten verschleppt wurden. Demnach wurden die Arten vorwiegend als Eigelege über Wasserpflanzen importiert. In Gewächs- oder Tropenhäusern konnten sie, wie z.B. für Ischnura senegalensis berichtet, zur Entwicklung kommen. Da es sich bei den bisher nachgewiesenen verschleppten Arten um sehr anpassungsfähige, meist multivoltine Arten handelt, ist nicht auszuschließen, dass diese aus den Gewächshäusern entweichen und sich erfolgreich im Freiland reproduzieren können.
4.2 Urbanitätsgradient
Der Begriff Urbanitätsgradient besagt, dass sich Organismen abgestuft vom Stadtzentrum zur Peripherie einer Stadt verteilen (Klausnitzer & Richter 1983, Sukopp 1990). Urbanitätsgradienten sind vor allem für Tagfalter, Laufkäfer, Vögel, Flechten und Moose nachgewiesen worden (Abs et al. 2005, Blair 1999, Gilbert 1989, Kübler 2005, Niemelä & Kotze 2009, Weller & Ganzhorn 2004). McKinney (2008) verglich 105 internationale Publikationen zum Nachweis von Urbanitätsgradienten bei Pflanzen, Wirbeltieren (außer Vögeln) und Wirbellosen. Er unterschied in die drei hier gewählten Zonen Innenstadt, Stadtrand und Umland. Dabei zeigte sich ein deutlicher Unterschied zwischen Pflanzen- und Tierarten. Zwei Drittel (65 %) aller Studien über Pflanzenarten zeigten eine Zunahme vom Umland zum Stadtrand. Studien an Tieren wiesen dagegen meist Abnahmen nach, bei Wirbellosen galt dies für 64 % aller Studien, bei Wirbeltieren waren es sogar 82 %. Die Artenvielfalt war bei Pflanzen in 70 % der Fälle am Stadtrand am höchsten, bei Wirbeltieren und Wirbellosen dagegen zu 66 bis 72 % im Umland. Für Vogelarten ermittelten Chace & Walsh (2006) und Marzluff (2001) Ähnliches.
Abs et al. (2005) unterschieden die Avifauna von Berliner Friedhöfen hinsichtlich Generalisten und Spezialisten und konnten gegensätzliche Entwicklungen zeigen. Während die Dominanz der Generalisten entlang des Gradienten zum Umland hin abnahm, wuchs die Dominanz der Spezialisten. In dieser Studie zeigte sich für die Libellen eine ähnliche Verteilung. In den Innenstädten dominierten die Generalisten, Spezialisten sind kaum zu finden. Zum Umland nahm der Anteil der Spezialisten deutlich zu und sie überwogen schließlich. Clark et al. (2007) wiesen bei Tagfaltern ebenfalls einen Rückgang der Spezialisten mit steigender Urbanisierung nach. Somit sind Spezialisten in einem viel stärkeren Maß von der Urbanisierung betroffen als Ubiquisten. Sie finden weniger geeignete Habitate und sind gleichzeitig kaum in der Lage, neue Habitate zu besiedeln.
McDonnell & Hahs (2008) folgerten, dass das Verhalten der Arten bezüglich eines Urbanitätsgradienten sehr unterschiedlich ist, von vielen Faktoren abhängt und keinesfalls pauschaliert werden kann. Bei der Analyse von Urbanitätsgradienten sind unterschiedliche Betrachtungsebenen zu berücksichtigen. In dieser Studie konnte auf Einzelgewässerebene (Habitatebene) kein Urbanitätsgradient bezüglich der Artenzahl für die Libellen der Städte Mainz und Münster ermittelt werden. Die Artenvielfalt der Libellen pro Gewässer hängt stark von der Größe und dem Vegetationsangebot ab (Bräu 1990, Willigalla & Fartmann 2009). Sofern sich geeignete Habitate innerhalb der bebauten Bereiche befinden, sind Libellen durchaus in der Lage, diese auch erfolgreich zu besiedeln.
Da in der Summe die geeigneten Habitate zum Umland hin zunehmen, zeigt sich ein deutlicher Urbanitätsgradient der Artenzahl erst bei Aggregierung sämtlicher Gewässer unterschiedlicher Stadtzonen (Landschaftsebene).
4.3 Homogenisierung durch Urbanisierung
Nach McKinney (2006) führt die zunehmende Bebauung von Regionen zu einer biotischen Homogenisierung. Dass heißt, die ursprünglichen Biozönosen werden zunehmend durch wenige ubiquitäre, weit verbreitete Arten ersetzt. Kühn & Klotz (2006) zeigten bei Pflanzen, dass Pflanzengesellschaften in urbanen Räumen eine größere Ähnlichkeit untereinander aufweisen als in unbebauten Bereichen. Clergeau et al. (2006) untersuchten die Vogelzönosen von europäischen Städten. Dabei unterschieden sie ebenfalls die drei hier gewählten Stadtzonen. Sie wiesen eine deutliche Artenverarmung in der Innenstadt nach und konnten zeigen, dass die Ähnlichkeit der Zönosen des Stadtrandes zu 89 %, die der Innenstadt nur zu 52 % von der geographischen Lage abhing.
Die Libellenfaunen der untersuchten Städte waren sehr ähnlich. Aufgrund der großen Entfernung zwischen den einzelnen Städten bzw. der Lage in unterschiedlichen geographischen Regionen wäre eine größere Differenzierung zu vermuten gewesen. Bei den zehn Studien zur Libellenfauna unbebauter Räume lag der SK mit 0,71±0,01 im Mittel signifikant niedriger als bei Libellenfaunen von Städten (MWU, U=3116,50, P<0,01). Für die Libellenfauna zeigte sich innerhalb der Stadtgrenzen ebenfalls eine signifikante höhere Ähnlichkeit als in unbebauten Räumen. Die hohe Ähnlichkeit der gesamten Stadtfauna lag allerdings auch darin begründet, dass die einzelnen Autoren jeweils nahezu sämtliche Gewässertypen eines Stadtgebietes inklusive der Überreste der Naturlandschaften innerhalb der Stadtgrenzen untersucht haben und somit das größtmögliche Artenspektrum nachgewiesen wurde.
Hinsichtlich der Ähnlichkeit der Libellenzönosen war eine Zunahme vom Umland hin zur Innenstadt vermutet worden, da angenommen wurde, dass die Anzahl unterschiedlicher Gewässertypen und damit potenzieller Nischen für die Arten geringer werden. Es zeigte sich allerdings kein Unterschied zwischen dem Umland und dem Stadtrand, die Zönosen der Innenstadt schließlich wiesen eine signifikant geringere Ähnlichkeit auf. Dies wird damit erklärt, dass die Anzahl und Ausprägung von Gewässern innerhalb der Innenstädte so rudimentär war, dass selbst die 21 ubiquitären Arten nicht in jeder Stadt ausreichende Habitate vorfanden. Der Stadtrand hingegen fungierte als annähernd gleichwertiger Lebensraum wie das naturnahe Umland. Für die Libellenfauna waren noch ausreichende Strukturen vorhanden. Im Innenstadt- und Stadtrandbereich erreichten 44 % der Arten eine hohe Stetigkeit, während es im Umland nur 35 % sind, was ebenfalls auf eine biotische Homogenisierung hindeutet.
Die Ergebnisse deckten sich recht gut auch mit den Angaben weiterer libellenkundlicher Publikationen, die nicht fundpunktgenau ausgewertet werden konnten (Handke et al. 1986, Schlüpmann 2001). Insgesamt sind 10 % der in Deutschland vorkommenden 81 Libellenarten mäßig urbanophil, rund 27 % urbanoneutral und 63 % aller Arten (mäßig) urbanophob. Die 17 weiteren in Deutschland bekannten Arten wurden in keiner der recherchierten Städte nachgewiesen. Sie wurden demnach als urbanophob eingestuft.
4.4 Libellenzönosen
Innenstädte weisen eine nur rudimentär ausgeprägte Libellenzönose auf. Sie setzt sich aus ubiquitären Arten zusammen, die geringe Ansprüche an ihre Umgebung stellen. Der größte Unterschied der Zönosen des Stadtrandes und des Umlandes findet sich erwartungsgemäß zwischen den Fließ- und Stillgewässerarten. Innerhalb der Stillgewässer sind die Unterschiede weniger deutlich. Hier fällt auf, dass die Teiche von einer relativ hohen Zahl von Arten stetig besiedelt werden. Dieser Artenpool der Teicharten teilt sich in zwei Gruppen auf, die eine bevorzugt die größeren offenen Stillgewässer, die andere die kleineren, vegetationsreicheren Teiche und Tümpel. Schlüpmann (2001) untersuchte 34 Gartenteiche der Stadt Hagen und ermittelte an diesen ähnliche Stetigkeiten wie die hier vorgelegten.
Die hier dargestellten Arten haben teilweise nur eine geringe Stetigkeit. Dies ist ein Hinweis auf regionale Unterschiede bei den Zönosen, wenn auch die Gesamtstadtfauna sich relativ ähnlich ist. Libellenzönosen sollten also eher regional oder naturraumbezogen betrachtet werden (vgl. Lohr 2007).
4.5 Gefährdung, Pflege- und Schutzmaßnahmen
Die meisten Gefährdungsursachen für Libellen in städtischen Biotopen sind bereits bekannt. So weisen gerade innerstädtische Teiche meist einen hohen Fisch- und Entenbesatz auf und eignen sich nicht mehr als Lebensraum für spezialisiertere Libellenarten (Ott 1995). Je intensiver der Freizeitdruck am Gewässer ist, desto weniger Arten sind zu erwarten. Durch die dichte Bebauung des Gewässerumfeldes finden Libellen kaum geeignete Nahrungs- und Reifungshabitate (Willigalla & Fartmann 2009). Die Isolation der Gewässer schließlich führt zu einer genetischen Verarmung der Populationen und erhöht somit auch das Aussterberisiko. Snep et al. (2006) zeigten anhand von Tagfaltern, dass in den Habitaten des Stadtrandes Spenderpopulationen existieren, von denen vor allem die mobilen Arten in der Lage sind, bis in die Innenstadt vorzudringen, wenn ein ausreichendes Netz an Trittsteinhabitaten vorhanden ist. Dies gilt auch für Libellen. Die höchsten Artenzahlen in der Innenstadt wurden in Münster ermittelt. Hier lagen auch die meisten untersuchten Gewässer. Nach einer Studie von Gledhill et al. (2008) bestand eine starke Korrelation zwischen Artenreichtum und Gewässerdichte innerhalb von Städten in England.
Durch die Anlage von Gartenteichen (Bräu et al. 2001, Ott 1993, Schlüpmann 2001) und Regenrückhaltebecken (Willigalla et al. 2003, Willigalla & Fartmann 2009) können einige ubiquitäre Arten bis in die bebauten Bereiche hinein gefördert werden. Die Mehrzahl der spezialisierteren Arten kommt nur sehr lokal innerhalb der Grenzen der Stadtgebiete vor (s. auch Bräu et al. 2001, Lenk 1992, Schwarz-Waubke & Schwarz 2000). Für den Schutz der aktuell gefährdeten Libellenarten sind daher strukturreiche Habitate des stadtnahen Umlandes von zentraler Bedeutung. Gleichzeitig sind diese stadtnahen Freiflächen durch einen starken Nutzungsdruck beeinträchtigt. Hier sollten in Zukunft Stadtentwicklungskonzepte greifen, die die wertvollsten Bereiche als „geschützte Landschaftsbestandteile“ ausweisen und vor Bebauung schützen.
4.6 Zeitliche Entwicklung der Libellenfauna in Städten
Für fünf Städte, Braunschweig, Hamburg, Mainz, Münster und München, lagen langjährige Beobachtungsreihen zum Vorkommen der Libellen vor. Die beste Datengrundlage existierte für die Stadt Münster. Hier konnte auf eine ca. 200-jährige Erfassungsgeschichte zurückgegriffen werden (Artmeyer et al. 2000). Für Münster zeigte sich im zeitlichen Verlauf zunächst eine Abnahme der Arten von 1975 bis etwa Mitte der 1990er Jahre. Seitdem wurde wieder eine Zunahme verzeichnet, wobei das ehemalige Niveau von ca. 50 Arten jedoch nicht erreicht werden konnte. Die Entwicklung der Zunahme der Artenzahl seit den 1990er Jahren wurde auch für die Städte Mainz (von 19 auf 36 Arten, Willigalla 2007, unpub.) und Braunschweig (von 30 auf 42 Arten, Suhling et al. 2009) nachgewiesen. Für die Stadt München zeigte sich im Vergleich von Daten vor 1970 zu Nachweisen zwischen 1990 und 2001 eine Abnahme von 46 auf 41 Arten (Bräu et al. 2001). Laut den Autoren bestanden für die Stadt München allerdings noch Erfassungslücken, so dass anzunehmen ist, dass das reale Artenspektrum etwas höher ist. Eine tendenzielle Zunahme der Artenzahl zeigte sich auch für Basel (Küry & Christ 2010). Es war in allen Städten ein ähnliches Muster zu erkennen: Vor 1975 waren die Artenzahlen am höchsten, danach nahmen sie bis in die 1980er Jahre ab. Seit ca. 1990 nahmen die Artenzahlen wieder zu, das ehemalige Niveau wurde allerdings noch nicht erreicht. Als Ursachen für die Artenzunahme werden folgende Punkte angenommen (Artmeyer et al. 2000, Bräu et al. 2001, Suhling et al. 2009, Willigalla 2007):
erhöhte Erfassungsintensität,
verbesserte Wasserqualität der Fließgewässer,
vermehrte Neuanlage und Pflege von Gewässern und Renaturierung von Fließgewässern,
Klimaerwärmung.
5 Fazit und Ausblick
Die Zentren mit hoher Libellenvielfalt innerhalb von Stadtgrenzen befinden sich am Stadtrand und im stadtnahen Umland. Nur einige ubiquitäre Arten sind in der Lage, auch Gewässer in dichter bebauten Bereichen zu besiedeln. Der Grad der Bebauung ist somit ein zentraler Gefährdungspunkt der Libellenfauna. Die stadtnahen Freiflächen und Gewässer sind von sehr großer Bedeutung für die Libellendiversität und den Erhalt auch gefährdeter Arten. Auf diese Biotope müssen sich zukünftige Schutzkonzepte konzentrieren.
Bei zukünftigen Untersuchungen sollte verstärkt die Abundanz der Arten betrachtet werden. Es wird vermutet, dass sich hier größere Unterschiede im Urbanitätsgradienten aufzeigen lassen, da mit Anstieg der Bebauung z.B. das Nahrungsangebot geringer wird. Von zentraler Bedeutung sind Aussagen darüber, welcher Bebauungsgrad noch tolerierbar für eine hohe Artenvielfalt ist. Ebenso ungeklärt ist die Frage, wie viele Gewässer pro km² von Nöten sind, um ein langfristiges Überleben von Populationen zu ermöglichen. Weiterhin sollten auch die ökologischen Gilden genauer betrachtet werden, da sich Generalisten und Spezialisten gegensätzlich entlang eines Urbanitätsgradienten verhielten.
Literatur
Aus Umfangsgründen wird das ausführliche Literaturverzeichnis nicht mit abgedruckt. Es steht hier zum Download zur Verfügung. Literaturverzeichnis zu "Willigalla, C., Fartmann, T. (2010): Libellen-Diversität und -Zönosen in mitteleuropäischen Städten – ein Überblick", Tab. 1 und 3
Literaturverzeichnis zu "Willigalla, C., Fartmann, T. (2010): Libellen-Diversität und -Zönosen in mitteleuropäischen Städten – ein Überblick", Tab. 1 und 3
Anschriften der Verfasser: Christoph Willigalla, Willigalla – Ökologische Gutachten, Am Großen Sand 22, D-55124 Mainz, E-Mail christoph@willigalla.de , PD Dr. Thomas Fartmann, Westfälische Wilhelms-Universität Münster, Institut für Landschaftsökologie, AG Biozönologie, Robert-Koch-Straße 28, D-48149 Münster, E-Mail fartmann@uni-muenster.de
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen






Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.