Ex-situ-Erhalt des Böhmischen Fransenenzians
Abstracts
Der Böhmische Fransenenzian (Gentianella bohemica) ist eine vom Aussterben bedrohte, zweijährige Art, die im Böhmischen Massiv heimisch ist und in Deutschland nur noch im Bayerischen Wald an wenigen Standorten vorkommt. Zur Erhaltung der Art werden seit 2004 im Ökologisch-Botanischen Garten der Universität Bayreuth ex-situ-Kulturen betrieben. Ziel ist es, Forschungen zum besseren Verständnis der Ökologie dieser Art durchzuführen und Vermehrungsmaterial für populationsstützende Maßnahmen am Wildstandort zu gewinnen. Im Rahmen von Versuchen zur Optimierung der Kulturführung sollte geklärt werden, inwieweit der Einsatz von Mykorrhiza-Präparaten Wachstum und Vitalität der Pflanzen fördert.
Gentianella bohemica gilt als schwer zu kultivieren, kann aber nach der hier präsentierten Methode erfolgreich zur Samenreife gebracht werden, auch wenn bislang nur etwa ein Fünftel der Keimlinge zur Fruktifikation gelangte. Die (Jung-)Pflanzen sind vor allem empfindlich gegenüber Störungen im Wurzelbereich (Verletzungen, Nässe und Trockenheit) sowie hohen Sommertemperaturen. In der Natur ist Gentianella bohemica mit arbuskulären Mykorrhiza-Pilzen der Gattung Glomus vergesellschaftet, gedeiht in Kultur aber auch ohne Mykorrhiza. Versuche mittels Präparaten, die Wurzeln der Keimlinge über Sporen zu mykorrhizieren, waren nicht erfolgreich. Die Gründe hierfür werden diskutiert.
Ex Situ-Preservation of the Bohemian Gentian – Experiences of the cultivation in the Botanical Gardens Bayreuth
Gentianella bohemica, an endemic species of the Bohemian Mountain range, is an endangered biennial species. In Germany it only occurs on few a sites in the Bavarian Forest. In 2004 an ex situ-culture of this species was established in the Ecological-Botanical Gardens (ÖBG) at the University of Bayreuth. The cultivation allows research into the ecology of this species, and seed and plant material can be gained in order to stabilise natural populations. Within the framework of cultivation experiments the impact of commercially available mycorrhizaspores on growth and vitality of the species has been tested.
Gentianella bohemica is regarded as difficult to cultivate but the method described has proven successful, although only one fifth of the seedlings cultivated has fructified. Seedlings and young plants are sensitive to root disturbances such as injury, stagnant moisture and drought as well as to hot summer conditions. In the wild Gentianella is in mycorrhizal symbiosis with fungi of the genus Glomus. Surprisingly, in pot culture it grows quite well without this mycorrhiza. Inoculation experiments with commercially available mycorrhizal spores failed. The paper discusses reasons.
- Veröffentlicht am
1 Einleitung
Seit der industriellen Revolution hat sich die Anzahl ausgestorbener und vom Aussterben bedrohter Arten drastisch erhöht (Dahl et al. 2000). Die sog. Roten Listen, die alljährlich vom IUCN (International Union for the Conservation of Nature) herausgegeben werden, verdeutlichen dies auch für die letzten Jahrzehnte. Daher sind über internationale Verträge (z.B. Convention on Biological Diversity = CBD; Rio de Janeiro 1992) alle Staaten und Regionen aufgefordert, die biologische Vielfalt zu erhalten. In Bayern kommen zahlreiche Pflanzenarten vor, die sowohl deutschland- als auch weltweit gesehen hier ihren Verbreitungsschwerpunkt haben (Berg 2001). Dazu zählt Gentianella bohemica, der Böhmische Fransenenzian, der nur im Grenzgebiet von Deutschland, Österreich und Tschechien vorkommt (Abb. 1). Er wird nach der Roten Liste Bayerns und Deutschlands als „vom Aussterben bedroht“ (Gefährdungsgrad 1) eingestuft und ist nach der Bundesartenschutzverordnung und der FFH-Richtline „streng geschützt“ (Landesamt für Umweltschutz 2003). Ehemals war die Art im Böhmischen Massiv sowohl in Borstgrasrasen wie in nährstoffreicheren, feuchten Wiesen und in Rotschwingel-Rotstraußgraswiesen (Dolek et al. 2007) durchaus häufig, wurde dort noch vor wenigen Jahrzehnten als so genanntes „Milchschlittengras“ gesammelt und als Teeaufguss den Kühen bei Eutererkrankungen verabreicht (Berg 2001). In den vergangenen Jahrzehnten wurde für Gentianella bohemica im gesamten Verbreitungsgebiet ein starker Bestandesrückgang beobachtet. In Böhmen und Mähren geht man davon aus, dass von den ursprünglich über 1100 Vorkommen aktuell noch ca. 40 vorhanden sind. In Bayern sind nur noch sechs Vorkommen bestätigt, deren Gesamtindividuenzahl von Jahr zu Jahr stark schwankt und von 1989 bis 2000 zwischen 43 und 1045 blühenden Individuen lag (Götz 1991, Rösler 2001). Die Schwankungen sind u.a. darauf zurückzuführen, dass Gentianella bohemica eine zweijährige Art ist, sich ausschließlich generativ vermehrt und somit alljährlich von günstigen Bedingungen für Keimung und Etablierung abhängig ist (siehe auch Dolek et al. 2007).
Im Rahmen des „Artenhilfsprogramm für endemische und stark bedrohte Pflanzenarten Bayerns“ des Bayerischen Landesamts für Umweltschutz wird seit 1989 versucht, die räumlich isolierten Restvorkommen von Gentianella bohemica im Bayerischen Wald zu erhalten (Berg 2001, Götz 1991, Rösler 2001). Seither ist zwar kein weiterer Rückgang zu verzeichnen, die Populationen sind aber nach wie vor akut gefährdet. Vor allem für Bestände mit wenig Individuen besteht aktuell ein hohes Aussterberisiko, was nicht zuletzt die Folge einer verminderten Fitness kleiner Populationen ist (vgl. Fischer & Schmid 1998).
Aus diesem Grund wurden vor einigen Jahren ex-situ-Erhaltungskulturen in verschiedenen Botanischen Gärten wie auch dem Ökologisch-Botanischen Garten (ÖBG) der Universität Bayreuth begründet (Dolek et al. 2007). Ziel dieser Kultur ist neben der Erhaltung der Art die Erforschung wichtiger populationsbiologischer Parameter, deren Kenntnis für den Schutz am Wildstandort wichtig sind. Zudem soll so Vermehrungsmaterial (Samen) gewonnen werden, um die Populationen in der Natur zu stabilisieren. Gentianella bohemica ist schwer zu kultivieren (z.B. Encke 1960). Im Rahmen der vorliegenden Studie wurde daher empirisch getestet, welche Substrate, Topftypen und Standorte für seine Kultur günstig sind und zu vitalen Pflanzen führen. Zudem wird für Gentiana und Gentianella-Arten ein verbessertes Wachstum durch Mykorrhizierung angenommen (Weber & Heymons 1987, Weiss 1933). In einem Experiment wurden daher käuflich erworbene Sporen der Mykorrhizapilz-Gattung Glomus dem Substrat zugegeben, um zu klären, ob auf diese Weise eine Mykorrhizierung bei Gentianella bohemica unter Kulturbedingungen induziert werden kann und ob diese Wachstum und Blütenbildung fördert.
2 Material und Methoden
2.1 Kulturführung
Für die Versuche zur Optimierung der Kulturführung wurde Saatgut von Gentianella bohemica von fünf verschiedenen Herkünften aus den Jahren 2004 bis 2007 verwendet (Tab. 1).
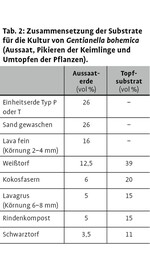
In Vorversuchen wurde die Eignung verschiedener Substrate, Standorte und Topftypen empirisch durch den betreuenden Gärtner bewertet. Für die Aussaat und die Weiterkultur wurden Aussaaterde und Topfsubstrat (Tab. 2) sowie TKS1 (Torf-Kultur-Substrat) mit variabler Zugabe von Lehm (bis zu 30%) bzw. Granitgrus (bis zu 30%) erprobt. Eine unterschiedliche Anzahl an Pflanzen wurde jeweils im Gewächshaus, im Folienhaus, im Frühbeetkasten oder direkt im Freiland kultiviert, um Erkenntnisse über die Temperatur- und Standortansprüche der Art zu gewinnen. Zudem wurde der Kulturerfolg in Abhängigkeit vom Topftyp (Ton- oder Plastiktopf) protokolliert.
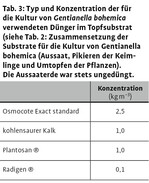
Aufbauend auf den Erfahrungen aus diesen Vorversuchen wird Gentianella bohemica im ÖBG nun folgendermaßen kultiviert. Im Herbst geerntete Samen werden kühl und trocken (Kühlschrank) gelagert und im anschließenden Winter (Dezember/Januar) in Tontöpfe (Durchmesser 13cm, etwa ¼ der Topfhöhe wird unten mit Torfmoosen und Tonscherben gefüllt) und Anzuchtplatten (QuickPot® QP 77, 40 x 40 x 50 mm) in Aussaaterde (Tab. 2) ausgesät, mit 0,15 Vol.-% Previcur®-Lösung (systemisches Fungizid, außer Mykorrhizaexperiment) abgegossen und drei bis vier Wochen in einem Gewächshaus bei einer mittleren Tagestemperatur von 20°C zum Quellen aufgestellt. Danach werden die Töpfe in ein unbeheiztes Folienhaus gebracht, wo sie zunächst den kalten, winterlichen Temperaturen ausgesetzt sind (Stratifizierung) und mit den ansteigenden Temperaturen im Frühjahr zu keimen beginnen. Die Keimlinge werden möglichst frühzeitig, sobald die Primärblätter etwa 0,5 cm lang sind (Abb. 2, links), einzeln oder zu wenigen in Tontöpfe (Durchmesser 6cm) in Topfsubstrat (Tab. 2 und 3) pikiert und danach in ein unbeheiztes Gewächshaus gebracht, in dem durch Schattierung eine zu starke Erwärmung im Frühsommer vermieden werden kann. Zu Beginn des Sommers bleibt ein Teil der Rosetten in diesem Gewächshaus, ein weiterer wird in Frühbeetkästen gebracht, wo die Tontöpfe in (feuchten) Sand eingesenkt werden (Abb. 2 rechts, Abb. 3). Soweit nötig werden die einjährigen Rosetten im Sommer in größere Tontöpfe (10 oder 11 cm Durchmesser) in aufgedüngtes Topfsubstrat (Tab. 2 und 3) umgetopft. Zur Überwinterung stehen die einjährigen Gentianella-Rosetten wieder im unbeheizten Gewächshaus. Im darauf folgenden Frühjahr werden sie erneut getopft (Durchmesser 13–14 cm je nach Größe der Pflanze) und im Frühbeetkasten oder im unbeheizten, schattierbaren Gewächshaus bis zur Fruchtreife weiter kultiviert.
Von den so kultivierten Gentianella-Pflanzen wurde, getrennt nach ihrer Herkunft (Tab. 1), bei Erreichen folgender vier Entwicklungsphasen deren Individuenzahl bestimmt: (1) junge, pikierte Keimlinge im Frühjahr nach der Aussaat, (2) einjährige Rosettenpflanzen im Herbst, (3) überwinterte Pflanzen und (4) blühende Individuen (Abb. 4).
Mit Einsetzen der Blüte ab Mitte Juni wurde mit einem Pinsel von Hand bestäubt, wobei stets fremdbestäubt wurde, aber mit Pollen von Individuen derselben Herkunft (Burkart & van den Driesch 2006). Die reifen Kapseln werden kurz vor dem Öffnen geerntet (Abb. 5) und die Samen bis zur Aussaat im Kühlschrank aufbewahrt.
2.2 Versuche zur Mykorrhizierung
2.2.1 Versuchsdesign
Vierzig einjährige Pflanzen einer Herkunft (071636, vgl. Tab.1) und 10 zweijährige zwei verschiedener Herkünfte (061839 und 061862) wurden bis zum Frühjahr 2008 wie in Abschnitt 2.1 beschrieben kultiviert. Im Frühjahr wurde beim Pikieren bzw. Umtopfen jeweils die Hälfte der Pflanzen in Substrat getopft, das mit Mykorrhiza-Pilzsporen beimpft war, die andere Hälfte in unbeimpftes Substrat. Dazu wurden Tontöpfe mit ungedüngtem Topfsubstrat für etwa fünf Stunden im Trockenschrank bei 170°C sterilisiert. Am folgenden Tag wurde bei allen Töpfen Dünger (Tab. 3) und bei der Hälfte das Mykorrhiza-Präparat INOQ Spezial® zu einer Endkonzentration von 5 Vol.-% (einjährige Rosetten) bzw. 10 Vol.-% (zweijährige Rosetten) untergemischt. Das Präparat enthielt Sporen der drei Endomykorrhizapilze Glomus etunicatum, Glomus intraradices und Glomus claroideum (292±35 Mykorrhiza-Einheiten pro cm³ Substrat, Trägermaterial: Torfsubstrat, Bezug direkt über den Hersteller INOQ GmbH).
2.2.2 Wachstumsanalysen
Das Wachstum wurde bei den einjährigen Rosetten vom 29. Mai bis zum 14. August 2008 und bei den zweijährigen Pflanzen vom 24. April bis zum 07. August 2008 einmal wöchentlich protokolliert. Bei den einjährigen Rosetten wurde Anzahl und Blattfläche aller grünen Blätter bestimmt, sobald sie in einem Winkel von mindestens 30° von der Sprossachse abspreizten. Zur Berechung der Fläche der lanzettlichen Blätter wurden Länge und Breite eines jeden Blattes gemessen, über eine Quadratfunktion (y=ax²+bx) der Kurvenverlauf des Blattrandes beschrieben und mittels zugehöriger Integralfunktion die Blattfläche berechnet. Zusätzlich wurde zu Beginn (23. April 2008) und am Ende des Versuches von jeweils drei bzw. fünf repräsentativen Jungpflanzen die Gesamtbiomasse (Trockengewicht) bestimmt.
Bei den zweijährigen Pflanzen wurden ab Mitte Juni 2008 täglich die Blüten pro Pflanze gezählt (sobald drei von fünf Kronblättern entfaltet waren). Jede gezählte Blüte wurde mit einem wasserfesten Filzstift am Kelch markiert, um Doppelzählungen zu vermeiden. Die reifen Fruchtkapseln wurden kontinuierlich geerntet, einzeln in Papiertüten verpackt und im Kühlschrank gelagert. Von jeder Kapsel wurden Samenzahl und -gewicht ermittelt und die Kapseln anschließend getrocknet und gewogen. Nach Ernte aller Kapseln wurde das Trockengewicht der restlichen oberirdische Biomasse der Pflanze bestimmt.
2.2.3 Nachweis der Mykorrhizierung
Der Mykorrhiza-Nachweis wurde an jeweils fünf Versuchspflanzen je Ansatz (mit und ohne Mykorrhizapräparat im Substrat) und Entwicklungsstufe durchgeführt (insgesamt 20 Pflanzen), sowie an Wurzelproben von Pflanzen, die am 22. und 23. September 2008 im Bayrischen Wald (Teufelsbachwiese: vier Rosetten, zwei blühende Pflanzen) und in Tschechien (Onšovice: drei Rosetten, ein blühendes Exemplar; Polna na šumave: eine Rosette, ein blühendes Individuum) gesammelt wurden.
Der Nachweis erfolgte durch Anfärben der Wurzel mit Anilinblau. Dazu wurde das Wurzelmaterial zum Bleichen für 5 bis 40 Minuten, je nach Dicke der Wurzel, in 65°C heißer, 5%iger KOH-Lösung gekocht, bis die Wurzelstücke glasig erschienen. Danach wurde das Material mit destilliertem Wasser abgespült, für eine Stunde in 1%iger Salzsäure bei Raumtemperatur eingelegt und erneut mit destilliertem Wasser gespült. Zur Färbung wurden die Wurzeln für 12 Minuten in eine 65°C warme Anilinblau-Lösung eingelegt (0,105 g Anilinblau, 70ml Glycerin, 70ml Milchsäure und 70ml destilliertes Wasser) und erneut gespült.
Der Nachweis der Mykorrhiza erfolgte qualitativ unter dem Lichtmikroskop. Die Anzahl der „Mykorrhiza-Knoten“ pro Wurzellänge wurde unter dem Binokular mit Hilfe eines Millimeter-Rasters ausgezählt.
2.3 Statistische Auswertung
Für die statistische Auswertung der Mykorrhiza-Experimente wurde das Programm STATISTICA 7 verwendet. Nach dem Kolmogorov-Smirnov-Test waren alle Daten normalverteilt. Signifikante Unterschiede wurden aufgrund des geringen Stichprobenumfanges mit dem Mann-Whitney-U-Test ermittelt. Bei der Anzahl der Samen pro Kapsel wurden die Mittelwerte der einzelnen Pflanzen als Einzelwerte behandelt. Als Signifikanzniveau wurde stets p<0,05 gewählt.
3 Ergebnisse
3.1 Kulturerfolg
Im Ökologisch-Botanischen Garten (ÖBG) der Universität Bayreuth ist die schwer zu kultivierende Gentianella bohemica seit 2004 erfolgreich in ex-situ Erhaltungskultur (Tab. 1). Durch die kontrollierten Bestäubungen wurden in ausreichendem Maße keimfähige Samen bestimmter Herkünften geerntet, die auch für die Ausbringung in der Natur verwendet wurden. Etwa ein Fünftel der pikierten Keimlinge erreicht letztendlich die Blüh- und Fruktifikationsphase (Abb. 6). Vor allem nach dem Pikieren der Keimlinge treten hohe Ausfälle auf (46 %), weitere 24% der Pflanzen überleben den darauffolgenden Winter nicht.
Aus den vor allem empirisch erhobenen Kulturführungsdaten lässt sich ableiten, dass die Art empfindlich gegenüber Störungen und möglichen Verletzungen im Wurzelbereich ist, da die Ausfallraten vor allem nach dem Pikieren hoch sind. Daher haben sich für die Aussaat Anzuchtplatten (sog. Quickpots) bewährt, da hier nicht pikiert werden muss, sondern die Keimlinge direkt umgetopft werden können. Ungünstig bei der weiteren Kultur sind hohe Temperaturen im Sommer, insbesondere auch im Wurzelbereich, sowie Staunässe und größere Feuchtigkeitsschwankungen im Substrat. Die Versuche haben gezeigt, dass Gentianella besser in durchlässigem Substrat gedeiht als in lehmigem und den Sommer über durch Beschattungsmaßnahmen vor zu hoher Wärme geschützt werden sollte. Aufgrund der Ansprüche nach ausgeglichener Bodenfeuchte und -temperatur hat sich das Einsenken der Töpfe den Sommer über in feuchten Sand bewährt und ist die Verwendung von Tontöpfen derjenigen von Plastiktöpfen vorzuziehen.
3.2 Mykorrhiza-Experiment
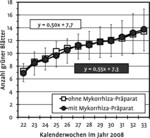
Wachstum. Einjährige Rosetten von Gentianella bohemica wuchsen im Beobachtungszeitraum von Ende Mai bis Mitte August mit und ohne Mykorrhizazugabe gleich gut (Abb. 7, Abb. 8 A). So nahm die Blattanzahl bei beiden Behandlungen von 7 auf 13 zu (Blattneubildungsrate: zwei Blätter pro Monat), die Blattfläche um 1,1 bis 1,5 cm² pro Woche (Daten nicht gezeigt). Die Gesamtbiomasse lag zu Versuchsbeginn bei 6±3mg Trockengewicht (23. April 2008) und nahm bis zum Versuchende (19. September bis 02. Oktober 2008) um das 40- bis 130-fache auf 250 bis 780mg zu (Abb. 8 A). Eine Abhängigkeit von der Behandlung mit dem Mykorrhiza-Präparat war nicht gegeben (Mann-Whitney-U-Test U = 6,00; p = 0,17), es fällt jedoch die große individuelle Variation im Wachstum der Pflanzen auf.
Auch bei den Pflanzen im zweiten Entwicklungsjahr war weder die Biomasse (Abb. 8B, Mann-Whitney-U-Test: U= 5,00; p=0,12) noch die Blütenzahl (Abb. 9A, Mann-Whitney-U-Test: U=2,00; p= 0,10) durch die Zugabe des Mykorrhiza-Präparates signifikant beeinflusst. Pflanzen im Substrat mit Mykorrhiza-Pilzen hatten im Mittel 108±27, die unbehandelten 56±35 Blüten pro Pflanze. Ebenso war die Anzahl der Samen pro Kapsel nicht signifikant von der Behandlung abhängig (Mann-Whitney-U-Test: U=2,00; p=0,25, Abb. 9B). Die in Mykorrhiza-Substrat kultivierten Pflanzen trugen 284 reife Kapseln, mit im Mittel 40±12 Samen, die Kontrollpflanzen insgesamt 115 Fruchtkapseln mit durchschnittlich 49±1 Samen pro Kapsel (Abb. 9B).
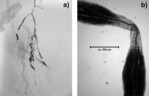
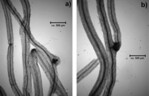
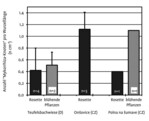
Mykorrhizierung. In keiner der untersuchten Wurzelproben der kultivierten Versuchspflanzen, konnte eine Mykorrhizierung nachgewiesen werden, auch nicht bei denjenigen, die in „Mykorrhiza-Substrat“ angezogen wurden (Abb. 10). An den am Wildstandort beprobten Pflanzen waren an den gewaschenen Wurzeln schon mit bloßem Auge durch Mykorrhiza entstandene Verdickungen erkennbar (Abb. 11a). Der Farbnachweis zeigte, dass alle elf untersuchten Wurzelproben mykorrhiziert waren (Abb. 11b, Abb. 12). Die Anzahl der „Mykorrhizaknoten“ pro Wurzellänge (0,4 bis 1,1 Knoten pro cm Wurzel, Abb. 12) variierte stark, ein Effekt der Standorte oder der Entwicklungsphase (ein- oder zweijährige Individuen) war nicht erkennbar.
4 Diskussion
Gentianella bohemica kommt endemisch im Böhmischen Massiv (Deutschland, Tschechien und Österreich) vor, ist vom Aussterben bedroht und deshalb im Ökologisch-Botanischen Garten (ÖBG) der Universität Bayreuth in ex-situ-Erhaltungskultur. Die Art lässt sich nur schwer kultivieren, was möglicherweise an der fehlenden Mykorrhiza unter Kulturbedingungen liegt, da Gentiana- und Gentianella-Arten normalerweise eine arbuskuläre Mykorrhiza haben (siehe z.B. Gallaud 1905, Weber & Heymons 1987, Weiss 1933). Diese Symbiose führt bei vielen Pflanzenarten zu einer verbesserten Wasser- und Nährstoffaufnahme (Feldmann 1998). So hatten mykorrhizierte Gentiana lutea-Pflanzen eine dreifach höhere Wurzelbiomasse (Weber & Heymons 1987), hatten Pelargonium zonale-Pflanzen eine längere Blühperiode und mehr Blüten und Anagallis arvensis und Manihot esculenta eine höhere Trockentoleranz als nicht mykorrhizierte (Feldmann 1998). Da sowohl Hersteller von Mykorrhizapräparaten (PBI-austria 2009, OpenPR 2008) als auch Gartenzeitschriften (Mein schöner Garten 2009) ihre leichte Anwendung und den Erfolg proklamieren, wurde in der vorliegenden Studie ein Mykorrhiza-Präparat (INOQ Spezial®) eingesetzt, das Sporen von drei Glomus-Arten enthielt, um die Kultur von Gentianella zu verbessern.
Pilze der Gattung Glomus, insbesondere diejenigen der Gruppe A (GlGrA), sind Mykorrhizapartner von Gentiana-Arten (Sýkorová et al. 2003) und von Gentianella bohemica (mdl. Mitteilung Matthias Dolek, Büro Ökologische Forschung Geyer & Dolek). Wie die vorliegenden Untersuchungen belegen, sind Gentianella bohemica-Wurzeln in der Natur mykorrhiziert. Allerdings erfolgte mit dem verwendeten Präparat unter den dargestellten Kulturbedingungen keine Mykorrhizierung, obwohl potentielle Endomykorrhizapilzpartner des Böhmischen Fransenenzians im eingesetzten Präparat enthalten sind (G. intraradices gehört zur Gruppe A, Schwarzott et al. 2001). Bisherige Studien bestätigen, dass die Inokulation mit Mykorrhizapilzen in der Kultur schwierig ist. Bei Gentiana verna zeigte sich, dass Wurzeln von Jungpflanzen nur mykorrhiziert wurden, wenn diese in eine bestehende mykorrhizierte Mischpopulation gepflanzt wurden (nurse plant effect), nicht aber wenn die entsprechenden Pilzsporen (vom Gentiana verna-Wuchsort isoliert) oder infizierte Wurzelstücke in das Kultursubstrat eingebracht wurden (Sýkorová et al. 2003). Bei Gentiana lutea (Jaquelinet-Jeanmougin & Gianinazzi-Pearson 1983), G. cruciata, G. decumbens and G. septemphyta (Demuth et al. 1991) hingegen gelang die Infektion über SporFür Gentianaceae ist der Paris-Mykorrhizatyp charakteristisch (Gallaud 1905, Weber 1984), bei dem die Pilzhyphen überwiegend geknäuelt und intrazellulär vorkommen. Außerhalb der Wurzel treten kaum Hyphen oder Sporen auf (Sýkorová et al. 2003), Substrate sind daher nahezu frei von Sporen, eine Übertragung des Pilzes von einer Enzianpflanze auf eine andere ist dadruch nicht ganz unmöglich, aber erheblich erschwert. Bedeutend für eine Infektion unter Kulturbedingungen könnte nun sein, dass ein und dieselbe Glomus-Art in einer anderen Pflanzenart den viel häufigeren und sog. Arum-Typ ausbilden kann (Demuth & Weber 1990, Weber et al. 1995), ein Typus, der auch außerhalb der Wurzeln Hyphen und Sporen bildet (Gallaud 1905). Demzufolge kann eine Infektion einer Pflanzenart mit Paris-Mykorrhizatyp nur in Mischkulturen erfolgreich sein, die eine Pflanzenart enthält, die mit dem gleichen Pilz einen Arum-Typ ausbildet. Welchen Typus Gentianella bohemica mit seinem Glomus-Partner ausbildet, ist bislang unklar, könnte aber entscheidend sein für eine Infektion unter Kulturbedingungen. So sollte in weiteren Untersuchungen der Pilzpartner molekularbiologisch identifiziert sowie der Mykorrhizatyp bestimmt werden. Diese so gewonnen Erkenntnisse könnten nicht nur einer Verbesserung der ex-situ-Kultur und damit einer höheren Samenausbeute dienen, sondern auch dem Schutz der Art am Wildstandort. Das Wissen über den Pilzpartner, seine Ansprüche und seine Bedeutung für die Vitalität des Enzians wären Voraussetzungen für effektive Pflegemaßnahmen (z.B. pH-Wert, Begleitvegetation) in der Natur.
Dank
Unser Dank gilt vor allem den Zuständigen des Gentianella-Artenhilfsprogrammes des Landesamtes für Umwelt (LfU) in Augsburg, Dr. Andreas Zehm und Dr. Matthias Dolek, sowie Thomas Engleder, dem Projektleiter des „Österreichischen Artenhilfsprojekts Böhmischer Enzian“ und Thomas Zipp für die gute Zusammenarbeit. Wir danken Marcus Stöckl vom Bayreuther Zentrum für Ökologie und Umweltforschung (BayCEER) für seine Hilfestellung bei den Mykorrhiza-Nachweisen und der Firma INOQ GmbH für deren Unterstützung und die Bereitstellung des Mykorrhizapräparates.
Literatur
Berg, M. (2001): Das Artenhilfsprogramm für endemische und stark bedrohte Pflanzenarten Bayerns. Schr.-R. Bayer. Landesamt für Umweltschutz 156, 19-88.
Burkart, M., van den Driesch, M. (2006): Global denken, regional handeln: Schutz der heimischen Wildpflanzen in botanischen Gärten. Der Palmengarten 70 (2), 146-157.
Dahl, H.-J., Niekisch, M., Riedl, U., Scherfose, V. (2000): Arten-, Biotop- und Landschaftsschutz. Band 8. In: Buchwald, K., Engelhardt, W., Hrsg., Umweltschutz: Grundlagen und Praxis, Economica, Heidelberg/Bonn, 424 S.
Demuth, K., Forstreuther, W., Weber, H.C. (1991): Morphological differencies in vesicular arbuscular Mycorrhizae of Gentianaceae produced by different endophytes. Flora 185 (2), 127-132.
–, Weber, H.C. (1990): Strukturelle Inkompatibilität der vesikulärarbuskulären Mycorrhizapilze in Enzianen (Gentianaceae). Angew. Bot. 64, 247-252.
Dolek, M., Zipp, T., Zehm, A. (2007): Böhmischer Enzian Gentianella bohemica Skal. In: Bayerisches Landesamt für Umwelt, Hrsg., Merkblatt Artenschutz 6.
Encke, F. (1960): Pareys Blumengärtnerei. Bd. 2. Parey, Berlin, Hamburg, 840 S.
Feldmann, F. (1998): Arbuskuläre Mykorrhiza im Gartenbau. Symbiosetechnologie in der Praxis. Thalacker, Braunschweig, 80 S.
Fischer, M., Schmid, B. (1998): Die Bedeutung der genetischen Vielfalt für das Überleben von Populationen. ANL, Laufener Seminarbeitr. 2/98, 23-30.
Gallaud, I. (1905) Études sur les mycorrhizes endotrophes. Rev. Gã. Bot. 17 (5).
Götz, S. (1991) Artenhilfsprogramm „Böhmischer Enzian“ (Gentianella bohemica SKAL.). Schr.-R. Bayer. Landesamt für Umweltschutz 102, 15-18.
Jacquelinet-Jeanmougin, S., Gianinazzi-Pearson, V. (1983): Endomycorrhizas in the Gentianaceae. I. The fungi associated with Gentiana lutea L. New Phytol. 95, 663-666.
Königer, J., Kiehl, K., Dolek, M., Zehm, A. (2008): Transboundary conservation and restoration efforts to preserve the strongly endangered endemic species Gentianella bohemica. 6th European Conference on Ecological Restoration, Gent, Belgien. 5 S.
Landesamt für Umweltschutz (Hrsg., 2003): Rote Listen gefährdeter Gefäßpflanzen Bayerns mit regionalisierter Florenliste. Schr.-R. Bayer. Landesamt für Umweltschutz 165, 374 S.
Mein schöner Garten (2009): http://www.mein-schoener-garten.de/de/site/gartenpraxis/ziergarten/ziergarten-standardartikel/Ziergarten-Standardartikel_46912.jsp , abgerufen am 22.04.2009.
OpenPR (2008): http://www.openpr.de/news/268241/Teamwork-seit-460-Millionen-Jahren-Mykorrhiza-Bodenpilze-und-Pflanzen.html, abgerufen am 22.04.2009.
PBI-austria (2009): http://www.pbi-austria.at/pbi-austria/malzkeimduenger/mykorrhiza/index.html, abgerufen am 22.04.2009.
Rösler, S. (2001): Das Artenhilfsprojekt Böhmischer Enzian (Gentianella bohemica Skalicky). Schr.-R. Bayer. Landesamt für Umweltschutz 156, 89-104.
Schwarzott, D., Walker, C., Schüßler, A. (2001): Glomus, the Largest Genus of the Arbuscular Mycorrhizal Fungi (Glomales), Is Nonmonophyletic. Molecular Phylogenetics and Evolution 21 (2): 190-197.
Sýkorová, Z., Rydlová, J., Vosátka, M. (2003): Establishment of mycorrhizal symbiosis in Gentiana verna. Folia Geobotanica 38, 177-189.
Weber, H.C. (1984): „Radix Gentianae“: Vom Enziandestillat zur Grundlagenforschung. Biol. Rundschau 22, 379-381.
–, Heymons, S. (1987) Gentianaceae: an excellent model to demonstrate the phylogenetic tendency of VA mycorrhiza. In: Sylvia, D.M., Hung, L.L., Graham, J.H., eds., Mycorrhiza in the next decade. Proceedings of the 7th North American Conference on Mycorrhizae, Gainsville, Florida. p 1.
–, Klahr, A., Marron-Heimbuch, M. (1995): Anatomical structures of the VA mycorrhiza in the Apocynaceae (Gentianales). Bot. Acta 108, 525-534.
Weiss, F. E. (1933): On the germination and the seedlings of gentians. Contributions from the Wisley Laboratory. Journal Royal Horticultural Society: Vol. LVIII (2), 296-300.
Anschriften der Verfasser(innen): Petra Zillig, Kerstin Lebermann, Dominik Morba, Guido Arneth und Dr. Marianne Lauerer, Ökologisch-Botanischer Garten, Universität Bayreuth, D-95440 Bayreuth, E-Mail marianne.lauerer@uni-bayreuth.de.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen









Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.