Bodenstörende Ökosystem-Ingenieure im mitteleuropäischen Grasland und ihre Bedeutung für die Biodiversität
Abstracts
Als Ökosystem-Ingenieure werden solche Organismen bezeichnet, die aktiv oder passiv die Ressourcenverfügbarkeit beeinflussen. Typische Beispiele für Ökosystem-Ingenieure sind bodenstörende Organismen wie etwa Ameisen und Maulwürfe, die durch ihre Lebensweise im Boden die physischen Bodeneigenschaften verändern und die Vegetation kleinräumig stören. Aufgrund der Erhöhung der Strukturvielfalt und Schaffung wärmebegünstigter Mikrohabitate ist der Einfluss derartiger Ökosystem-Ingenieure auf die Biodiversität von besonderem Interesse.
Zwei weit verbreitete Ökosystem-Ingenieure – die Gelbe Wiesenameise ( Lasius flavus ) und der Europäische Maulwurf ( Talpa europaea ) – und deren Bedeutung für die Biodiversität im mitteleuropäischen Grasland werden im vorliegenden Beitrag am Beispiel von Pflanzen (Gefäßpflanzen, Moose) und Schmetterlingen behandelt. Aufgrund von kleinräumigen Störstellen spielen diese eine Schlüsselrolle bei der Förderung konkurrenzschwacher und thermophiler Arten. Unter anderem nutzen störungsabhängige Schmetterlingsarten diese Mikrohabitate regelmäßig als Larvalhabitat, vor allem aufgrund des günstigen Mikroklimas und der teilweise hohen Wirtspflanzendeckung.
Der Förderung der Ökosystem-Ingenieure kommt eine besondere Bedeutung für den Erhalt der Artenvielfalt im Grasland zu. Dies gilt vor allem für produktive und verbrachte Bestände, in denen die Störstellen der Ökosystem-Ingenieure meist die einzigen Offenbodenhabitate darstellen.
Soil-disturbing ecosystem engineers in Central European grasslands and their relevance for biodiversity – Analysis using Yellow Meadow Ant and European Mole
Ecosystem engineers are organisms, which directly or indirectly influence the availability of resources by altering biotic or abiotic material. Typical examples of ecosystem engineers are soil-disturbing organisms such as ants and moles that alter soil conditions and disturb vegetation by their activities in the ground. Due to the increase in structural diversity and the creation of warm microhabitats, the influence of such species on biodiversity is of special interest. This review highlights the effects of the most widespread soil-disturbing ecosystem engineers in Central European grasslands – the Yellow Meadow Ant (Lasius flavus) and the European Mole (Talpa europaea) – on biodiversity based on case studies on plants (vascular plants, mosses) and butterflies. Due to the creation of small-scale microhabitats with a high amount of bare ground in ant hills and mole hills these ecosystem engineers are key organisms for the promotion of low-competitive and thermophilic species. As an example, these microhabitats serve as important larval habitats for disturbance-dependent butterfly species due to a warm microclimate and often a high cover of the host plants. The protection of these ecosystem engineers is therefore of special importance for the promotion of biodiversity in grasslands. This is especially true for fallow land and more productive sites where patches of bare ground are often scarce.
- Veröffentlicht am
1 Einleitung
1.1 Das Konzept der Ökosystem-Ingenieure
Der weltweite Rückgang der Artenvielfalt hat ein bislang unbekanntes Ausmaß erreicht. Der Mensch stellt hierbei die bedeutendste Bedrohung für die Biodiversität dar. Vor allem durch Landnutzungsänderungen, den Klimawandel und Eutrophierung werden erhebliche Artenrückgänge verursacht (Newboldet al. 2015,Salaet al. 2000,Streitbergeret al. 2016a, b). Aufgrund der stetigen Abnahme der Biodiversität ist die Umsetzung von Schutzmaßnahmen, die dieser Entwicklung entgegensteuern, dringend erforderlich. Dementsprechend ist die Naturschutzbiologie ein bedeutendes Forschungsfeld innerhalb der Ökologie (vgl.Begonet al. 2017).
Neben der Analyse der Wirksamkeit von Naturschutzmaßnahmen bildet die Untersuchung der funktionalen Zusammenhänge in Lebensgemeinschaften eine wichtige Grundlage, um Schutzstrategien abzuleiten. Für den Naturschutz ist vor allem die Identifizierung von Arten, die eine Schlüsselrolle für den Erhalt von Lebensgemeinschaften einnehmen oder eine Indikatorfunktion besitzen, von besonderem Interesse (z.B.Favreuaet al. 2006,Millset al. 1993).
Paine(1969) war einer der Pioniere, der die Bedeutung einzelner Arten für den Erhalt von Artengemeinschaften beleuchtete, indem er die trophische Schlüsselfunktion mariner Prädatoren für die Regulierung von Benthosgemeinschaften beschrieb. Auf dieser Grundlage wurde der Begriff der Schlusssteinarten ( keystone species ) geprägt (Millset al. 1993).
Einen Aufschwung bekam die Forschung zur Bedeutung von Arten für die Veränderung der Umwelt erst zu Beginn der 1990er-Jahre.Joneset al. (1994) entwickelten ein verallgemeinertes Konzept zur Bedeutung von Arten als sogenannte Ökosystem-Ingenieure ( ecosystem engineer ). NachJoneset al. (1994) sind Ökosystem-Ingenieure Organismen, die direkt oder indirekt die Verfügbarkeit von Ressourcen für andere Organismen beeinflussen, indem sie den physischen Zustand von biotischen oder abiotischen Bestandteilen der Umwelt verändern. Dabei wird zwischen auto- und allogenen Ökosystem-Ingenieuren unterschieden. Autogene Ökosystem-Ingenieure verändern die Umwelt direkt durch ihre körpereigenen Strukturen. Ein typisches Beispiel sind Pflanzen, die durch ihre Präsenz die Umwelt auf vielfältige Weise verändern, z.B. durch die Veränderung der Lichtverhältnisse, des Mikroklimas oder der Bodeneigenschaften (Joneset al. 1994). Im Gegensatz dazu verändern allogene Ökosystem-Ingenieure die Ressourcenverfügbarkeit durch die aktive Umwandlung von Ressourcen in einen anderen Zustand. Ein klassisches Beispiel sind Ameisen, die durch ihren Nestbau Sonderstrukturen mit lokal veränderten Bodenbedingungen schaffen (Folgarait1998).
Das Konzept der Ökosystem-Ingenieure wird oftmals mit dem der Schlusssteinarten in Verbindung gebracht. Die Festlegung von Unterschieden zwischen diesen beiden Auffassungen ist somit von zentraler Bedeutung in der theoretischen Ökologie (Wright & Jones2006). Im Gegensatz zu letzterem ist das Konzept der Ökosystem-Ingenieure nicht Ergebnis-, sondern Prozess-orientiert und auf die Modifikation der Umwelt durch Organismen ausgerichtet (Joneset al. 1997,Wright & Jones2006). Für die Naturschutzforschung ist vor allem die Bedeutung von Ökosystem-Ingenieuren für die Schaffung von Lebensräumen und deren Einfluss auf Artengemeinschaften von besonderer Bedeutung (z.B.Ewachaet al. 2016,Hagenah & Bennett2013,Nummi & Holopainen2014,Romeroet al. 2015). Dabei ist der Einfluss eines Ökosystem-Ingenieurs auf die Umwelt vor allem abhängig von der räumlichen Ausdehnung und der Nachhaltigkeit der Umweltveränderung sowie den populationsökologischen Eigenschaften des Ökosystem-Ingenieurs (Joneset al. 1994, 1997).
1.2 Bodenstörende Ökosystem-Ingenieure
Besonders gut untersuchte Beispiele für allogene Ökosystem-Ingenieure sind im Boden lebende Arthropoden wie Ameisen oder Termiten und bodenwühlende Säugetiere (z.B.Bartonet al. 2009,Davidsonet al. 2012,Davieset al. 2014,Deanet al. 1997,Hansell1993,Root-Bernstein & Ebensperger2013). Aufgrund der grabenden und nestbauenden Tätigkeiten rufen diese Organismen Veränderungen der Bodeneigenschaften hervor, modifizieren die Vegetationsstruktur kleinräumig und fungieren somit als Ökosystem-Ingenieure im Sinne vonJoneset al. (1994). Räumliche Forschungsschwerpunkte lagen bislang vor allem dort, wo bodenstörende Organismen – insbesondere sozial lebende Säugetiere – weit verbreitet sind, so etwa in den Steppen und Wüsten Nordamerikas oder Asiens (Davidsonet al. 2012). Da diese Offenlandlebensräume relativ strukturarm sind, ist der Einfluss der durch Ökosystem-Ingenieure geschaffenen Strukturen an oder in Nähe der Bodenoberfläche (v.a. Nester und Bodengänge) auf Artengemeinschaften besonders groß. Die durch die Öffnung der Vegetationsdecke entstandenen Mikrostrukturen und mikroklimatischen Gunststandorte spielen vor allem für Arthropoden und generell für wechselwarme Arten eine bedeutende Rolle (z.B.Davidson & Lightfood2007,Galvez Bravoet al. 2009). Aufgrund der weiten Verbreitung von bodenstörenden Ökosystem-Ingenieuren in diesen strukturarmen Habitaten ist es für den Biodiversitätsschutz besonders wichtig, ihre Auswirkungen auf Arten und Lebensgemeinschaften zu verstehen (Davidsonet al. 2012).
Auch in den europäischen Grasland-Ökosystemen gibt es bodenstörende Ökosystem-Ingenieure, die durch ihre Grabtätigkeit die Strukturvielfalt erhöhen und ein charakteristisches Mikrorelief schaffen. Typische Beispiele sind die Gelbe Wiesenameise ( Lasius flavus ), das Europäische Wildkaninchen ( Oryctolagus cuniculus ) und der Europäische Maulwurf ( Talpa europaea ) (Deanet al. 1997,Dostál2005,Gálvez Bravoet al. 2009;King1977a, b, c;Seifanet al. 2010). Insbesondere die Gelbe Wiesenameise und der Europäische Maulwurf sind in Mitteleuropa weit verbreitet und besiedeln eine große Vielfalt an unterschiedlichen Graslandlebensräumen. Während die Gelbe Wiesenameise oberirdische Erdnester anlegt, die unter günstigen Umständen mehrere Jahrzehnte erhalten bleiben (King1977b,Seifert2007), schafft der Europäische Maulwurf durch seine Grabtätigkeit temporäre Störstellen, die rasch von den umgebenden Pflanzenarten besiedelt werden.
Die Gelbe Wiesenameise kommt bevorzugt im mesophilen Grasland vor, besiedelt aber auch Magerrasen, Moore und Wälder (Seifert1993, 2007). Sie lebt hypogäisch und legt oberirdische Erdnester an (Abb. 1a), die eine Höhe bis zu 60 cm und einen Durchmesser bis zu 1 m erreichen können (Dlussky1981). Die Anlage der Erdnester dient dazu, möglichst günstige mikroklimatische Bedingungen für die Reproduktion zu schaffen (Dlussky1981,King2006). Die Ameise ernährt sich hauptsächlich von Wurzelläusen und deren Honigtau (Pontin1978). Durch die unterirdische Aktivität wird der Boden regelmäßig im Nest bewegt und aufgeworfen. Aufgrund der Störung weisen die Nester spezifische Bodenverhältnisse (Dauberet al. 2008,Dostálet al. 2005) und eine spezifische Vegetation auf, die sich von der Umgebung unterscheidet (Deanet al. 1997,King1977a,Lenoir2009). Die Intensität des Nestbaus ist vor allem von der Vegetationsstruktur, dem Mikroklima und den Bodenverhältnissen der Habitate abhängig. Vor allem in Brachen bzw. an Standorten mit hochwüchsiger Vegetation werden besonders große Erdnester angelegt, um so mikroklimatisch günstige Verhältnisse im Nest zu schaffen (Blomqvistet al. 2000).
Der Europäische Maulwurf kommt in einer großen Zahl unterschiedlicher Lebensräume vor, so etwa in Wäldern, im Grasland und urbanen Habitaten wie Gärten und Parkanlagen (Atkinson2013,Gorman & Stone1990,Mellanby1971,Witte1997). Er lebt solitär, territorial und mehr oder weniger vollständig unterirdisch (MacDonaldet al. 1997). Die Nahrung besteht aus Invertebraten, insbesondere Regewürmern (Atkinson2013,Gorman & Stone1990,Mellanby1971). Im Boden ist der Maulwurf grabend tätig, um Nester und Tunnel für die Nahrungssuche anzulegen. Hierdurch wird der Boden gestört und die Vegetation lokal verändert (z.B.Canals & Sebastià2000,Seifanet al. 2010). Typisch sind vor allem die Bodenauswürfe in Form von Maulwurfshaufen (Abb. 1b), die durch die Anlage unterirdischer Tunnel entstehen (Atkinson2013,Mellanby1971). Neben den charakteristischen Maulwurfshaufen ruft die Art unter bestimmten Bedingungen weitere Bodenstörungen hervor, wie oberflächennahe Tunnel und sogenannte Burgen, oberirdisch angelegte Nester (Atkinson2013,Mellanby1971). Aufgrund der intensiven Bodenstörung wird der Maulwurf oftmals als Schädling in der Landwirtschaft angesehen, unter anderem durch Probleme bei der Mahd und die Verschlechterung der Heu- oder Silagequalität durch die Verunreinigung mit Bodenmaterial und Bakterien (Atkinsonet al. 1994).
1.3 Bedeutung von Störungen für die Biodiversität im mitteleuropäischen Grasland
Extensiv genutzte Graslandökosysteme, die durch traditionelle Nutzung entstanden sind, stellen besonders artenreiche Lebensräume dar (Veenet al. 2009). Aufgrund des rezenten Landnutzungswandels sind diese Lebensräume allerdings stark gefährdet und gehen europaweit in ihrer Flächenausdehnung zurück (Cousins & Eriksson2008,Hooftmann & Bullock2012). Vor allem die Intensivierung oder Aufgabe der landwirtschaftlichen Nutzung sowie die Eutrophierung und Fragmentierung sind bedeutende Gefährdungsfaktoren für die Artenvielfalt des Graslandes (Hooftman & Bullock2012,Krämeret al. 2012b,Nilssonet al. 2013,McCleanet al. 2011,Poniatowskiet al. 2016).
Intensivierung und Nutzungsaufgabe sowie Eutrophierung führen gleichermaßen zu einer geschlossenen Vegetationsdecke und Homogenisierung des Graslandes (Ceulemanset al. 2013,Duprèet al. 2010,Mariotteet al. 2013,Prévostoet al. 2011). Traditionell genutztes Grasland war einst gekennzeichnet durch eine hohe Standortvielfalt (z.B. ausgeprägte Bodenfeuchte-, Expositions- und Nährstoffgradienten) und ein vielseitiges Nebeneinander unterschiedlich intensiv genutzter Bereiche (Diacon-Bolliet al. 2012). Die Erhaltung einer heterogenen Habitatstruktur hat somit heutzutage für die Förderung der Biodiversität im Grasland eine besonders große Bedeutung (vgl.Morris2000,Warrenet al. 2007).
Vor allem thermophile Insektenarten (z.B.Fartmann2006, Warren & Büttner2008) und konkurrenzschwache Pflanzenarten sind auf eine regelmäßige Störung angewiesen, die eine Öffnung der Vegetationsdecke bewirken und Regenerationsnischen schaffen (Fleischeret al. 2013,Freiet al. 2012,Tschöpe & Tielbörger2010). Folglich konzentrieren sich viele Naturschutz- und Renaturierungsmaßnahmen auf die Erhaltung einer vielfältigen und offenen Vegetationsstruktur. Dabei spielen vor allem eine extensive Beweidung, bei der durch Tritt Offenboden geschaffen wird (Bullocket al. 1994), oder auch mechanische Bodenstörungen eine bedeutende Rolle (Fleischeret al. 2013,Ödmanet al. 2012).
Neben anthropogen bedingten Störungen rufen auch die vorgestellten Ökosystem-Ingenieure kleinräumige Bodenstörungen im Grasland hervor. Somit haben diese Organismen das Potenzial, thermophile und konkurrenzschwache Arten zu fördern. Auch wenn es aus Nordamerika und Asien bereits intensive Studien zum Einfluss bodenstörender Ökosystem-Ingenieure auf Grasland-Lebensgemeinschaften gibt, ist der Kenntnisstand zu diesem Thema in Mitteleuropa noch gering. Lediglich der Einfluss der Gelben Wiesenameise auf die Vegetation wurde in mehreren Studien analysiert (z.B.Deanet al. 1997;King1977a, b, c;Lenoir2009). Analysen zur Bedeutung der Ökosystem-Ingenieure für die Fauna des Graslandes fehlen dagegen nahezu komplett.
Im Folgenden werden die wichtigsten Ergebnisse unserer Arbeiten (Streitberger & Fartmann2013, 2015, 2016;Streitbergeret al. 2014, 2017) sowie das bekannte Literaturwissen zur Bedeutung der Ökosystem-Ingenieure Gelbe Wiesenameise und Europäischer Maulwurf für die Phytodiversität (Gefäßpflanzen, Moose) und störungsabhängige Schmetterlingsarten in Kalkmagerrasen und im mesophilen Grasland vorgestellt. Aufbauend auf den Erkenntnissen wird die naturschutzfachliche Bedeutung der Ökosystem-Ingenieure im Grasland beleuchtet.
2 Auswirkungen von Ökosystem-Ingenieuren auf die Biodiversität im mitteleuropäischen Grasland
2.1 Einfluss vonL.asius flavus auf Gefäßpflanzen und Moose
Aufgrund der Langlebigkeit der Wiesenameisenester ist deren Bedeutung für die Phytodiversität schon lange ein beliebtes Forschungsobjekt. Bereits in den 1970er-Jahren wurde die Vegetation der Nester von L . flavus durchKing(1976; 1977a, b, c; 1981) intensiv in den Kalk- und Silikatmagerrasen Englands studiert. Struktur und Artenzusammensetzung der Vegetation der Ameisenhaufen sind sehr spezifisch, typischerweise handelt es sich um artenarme Ausbildungen der umliegenden Matrix-Vegetation (Deanet al. 1997,Dauberet al. 2006,King1977a,Lenoir2009).
Auf die grundlegenden Untersuchungen vonKingfolgten spezifischere Studien, so etwa tiefergehende Analysen zur Samenbank in Ameisennestern (Dauberet al. 2006,Dostál2005,King2007,O’Gradyet al. 2013) oder zum Einfluss der Nutzung auf die Vegetation an Ameisennestern (Blomqvistet al. 2000,Lenoir2009,Veen & Olff2011,Veenet al. 2012). Vor allem die Ausbreitungsstrategie, das Samengewicht und die Wuchsform von Arten bestimmen das Vorkommen von Gefäßpflanzen an Ameisennestern (Dauberet al. 2006;King1976,1977c). Besonders typisch sind annuelle Arten oder Sippen, die durch ihr vegetatives Ausbreitungsvermögen an die regelmäßige Bodenstörung angepasst sind und Überdeckungen mit Bodenmaterial problemlos überstehen wie etwa die Thymus -Arten (King1977c).
Bislang fehlten allerdings vegetationsökologische Studien, die die unterschiedlichen Expositionen der Nestseiten mit einer hinreichenden Anzahl an Stichproben berücksichtigten. Dies gilt insbesondere für Arbeiten, die auch Moose beinhalten (z.B.King1981, 2003;Woodell & King1991). In den Kalkmagerrasen des Diemeltals (Nordhessen/Ostwestfalen) wurden die Habitatpräferenzen von L . flavus (Streitberger & Fartmann2016) und die Vegetation (Gefäßpflanzen, Moose) der Nord- und Südseiten der Ameisennester intensiv untersucht (Streitbergeret al. 2017).
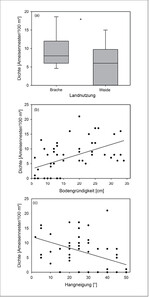
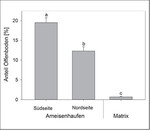
Die Gelbe Wiesenameise präferiert im Diemeltal Kalkmagerrasen, die brachliegen, tiefgründig und wenig geneigt sind (Abb. 1a, 2). Die Ameisenhaufen sind im Vergleich zur Matrixvegetation durch einen deutlich höheren Anteil an Offenboden gekennzeichnet (Abb. 3). Dabei unterscheidet sich die Vegetation entsprechend der Exposition der Nestseite und der damit zusammenhängenden unterschiedlichen Aktivität von L . flavus . Die Gelbe Wiesenameise baut ihre Nester aufgrund der günstigen mikroklimatischen Bedingungen meist in südlicher Richtung aus (Dlussky1981,Schreiber1969). Entsprechend weisen die Südseiten den höchsten Offenbodenanteil auf (Abb. 3) und sind trockener als Wuchsorte der Matrixvegetation (Tab. 1a). Im Gegensatz dazu stellen die Nordseiten Übergänge zwischen den offenen Südseiten und der dichtwüchsigen Matrix-Vegetation dar. Durch die offene Vegetationsstruktur sind die Ameisennester mikroklimatische Gunststandorte, die sich in Folge der hohen Sonneneinstrahlung tagsüber durch ein wärmeres Mikroklima im Vergleich zur umliegenden Vegetation auszeichnen (Abb. 4).
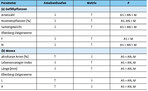
Wie bereits vorherige Studien gezeigt haben (Dauberet al. 2006,Deanet al. 1997,Lenoir2009), ist auch im Diemeltal die Vegetation der Ameisennester ärmer an Gefäßpflanzen im Vergleich zur Matrix (Tab. 1a). Darüber hinaus dominieren Arten mit geringem Samengewicht (Tab. 1a). Beides gilt vor allem für die Südseiten der Nester (Tab. 1a). Im Gegensatz dazu kommen Rosettenpflanzen in geringerer Abundanz an den Ameisenhaufen vor, da sie empfindlich auf Bedeckung mit Bodensubstrat reagieren. Die Nester von L . flavus weisen unter den Gefäßpflanzen auch nur wenige Indikatorarten nachDufrêne & Legendre(1997) auf (Streitbergeret al. 2017): Indikatorarten der Südseiten sind Arenaria serpyllifolia und Thymus praecox , für die Nordseiten gelten Brachypodium pinnatum , Medicago lupulina , Pimpinella saxifraga und Thymus pulegioides als Indikatorarten (s. auch Abb. 5). Im Vergleich dazu wurde für die Matrix-Vegetation eine große Zahl an typischen Kalkmagerrasenarten als Indikatorarten festgestellt (s.Streitbergeret al. 2017). Aufgrund der stark erhöhten Deckung bestimmter Indikatorarten (vor allem Thymus -Arten) und der intensiven Bodenstörung weisen die Nester eine sehr spezifische Vegetationsstruktur und damit zusammenhängend ein warmes Mikroklima auf (Abb. 4).
Im Gegensatz zu den Gefäßpflanzengesellschaften grenzen sich die Südseiten der Nester sehr deutlich durch charakteristische Moosgesellschaften und spezifische Merkmalseigenschaften sowohl von den Nordseiten als auch der Matrix-Vegetation ab (Tab. 1b). Während die Nordseiten und die Matrix vor allem durch langlebige, pleurokarpe Arten dominiert werden, zeichnen sich die Südseiten durch einen hohen Anteil kleinwüchsiger, akrokarper sowie kalk- und lichtliebender Moosarten mit einem niedrigen Lebensstrategie-Index aus. Demnach werden an den Nestern vor allem kurzlebige Arten und Sippen, die durch eine hohe Reproduktionsrate gekennzeichnet sind, gefördert (Streitbergeret al. 2017). Es handelt sich generell um ruderale, konkurrenzschwache, basiphile und austrocknungsresistente Arten, die auf Offenboden angewiesen sind und nur selten in der Matrix vorkommen (Streitbergeret al. 2017).
Durch die Öffnung der Vegetationsdecke spielt L . flavus demnach eine besondere Rolle für die Förderung der Moosdiversität im Grasland. Typisch für Ameisennester sind unter anderem Arten der Gattungen Barbula , Bryum und Weissia sowie Pottia lanceolata (Streitbergeret al. 2017; s. auchMarstaller2007). Die Nordseiten und die Matrix-Vegetation haben dagegen mit Plagiomnium affine und Scleropodium purum bzw. Ctenidium molluscum und Hypnum cupressiforme nur wenige Indikatorarten. Scleropodium purum ist an den Nordseiten sehr konkurrenzkräftig, schafft es aufgrund des Vertrocknungsrisikos aber nicht, sich an den Südseiten der Nester zu etablieren (King2003).
2.2 Die Bedeutung von Ameisen- und Maulwurfshaufen für Schmetterlinge
Extensiv genutztes Grasland – vor allem Kalkmagerrasen – gehört zu den artenreichsten Schmetterlingslebensräumen in Mitteleuropa (Fartmann2004,van Swaay2002,van Swaayet al. 2006,Krämeret al. 2012b). Die meisten Schmetterlingsarten haben sehr spezifische Ansprüche an die Habitatqualität und -verfügbarkeit. Folglich zählen Schmetterlinge zu den gefährdetsten Artengruppen weltweit und in Europa (Thomas & Clarke2004). Viele Arten sind mono- oder oligophag und daher an das Vorkommen spezifischer Wirtspflanzen in ausreichender Menge gebunden (Fartmann & Hermann2006,Garcia-Barros & Fartmann2009,Munguiraet al. 2009).
Aufgrund der längeren Lebensdauer und fehlenden bzw. geringen Mobilität haben die Präimaginalstadien von Schmetterlingen deutlich spezifischere Ansprüche an ihren Lebensraum als das Adultstadium (Fartmann2004, Fartmann & Hermann2006,Garcia-Barros & Fartmann2009). Neben dem Vorkommen der Wirtspflanzen ist vor allem ein günstiges Mikroklima für die Larvalentwicklung entscheidend (Fartmann & Hermann2006,Garcia-Barros & Fartmann2009). Das Mikroklima ist eng mit der Vegetationsstruktur verbunden (Stoutjesdijk & Barkmann1992). Viele thermophile Arten sind aufgrund des günstigeren Mikroklimas auf eine offene Vegetation oder Offenbodenstellen als Ei- und Larvalhabitat angewiesen (z.B.Helbinget al. 2015,Krämeret al. 2012a,Löffleret al. 2013,Möllenbecket al. 2009;Salz & Fartmann2009, 2017). Für den Schutz von Schmetterlingen im Grasland hat die Erhaltung einer heterogenen Vegetationsstruktur somit eine besonders hohe Bedeutung.
Die Gelbe Wiesenameise und der Europäische Maulwurf leisten einen wesentlichen Beitrag zur Öffnung der Grasnarbe und Erhöhung der Strukturvielfalt im Grasland. Daher wurde die Bedeutung der durch diese Ökosystem-Ingenieure hervorgerufenen Störstellen als mögliche Larvalhabitate für störungsabhängige Schmetterlinge detailliert untersucht (s.Streitberger & Fartmann2013, 2015, 2016;Streitbergeret al. 2014). Die vier ausgewählten Arten Kleiner Feuerfalter ( Lycaena phlaeas ), Kleiner Würfel-Dickkopffalter ( Pyrgus malvae ), Komma-Dickkopffalter ( Hesperia comma ) und Thymian-Widderchen ( Zygaena purpuralis ) sind in den Untersuchungsgebieten mono- oder oligophag sowie auf Offenboden und ein warmes Mikroklima für die Larvalentwicklung angewiesen (Fartmann2004,2006; Fartmann & Mattes2003,Streitbergeret al. 2014).
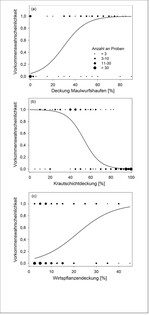
Die durch die Ökosystem-Ingenieure hervorgerufenen Störstellen in Kalkmagerrasen bzw. im mesophilen Grasland werden von allen vier Schmetterlingsarten gegenüber der Matrixvegetation zur Eiablage bzw. als Larvalhabitat präferiert (Streitberger & Fartmann2013, 2015, 2016;Streitbergeret al. 2014). Lycaena phlaeas ernährt sich monophag von Rumex -Arten – vor allem Großem Sauerampfer ( R . acetosa ) –, ist weit verbreitet und kommt in einer großen Zahl an Offenlandhabitaten vor (Ebert & Rennwald1991). Aktuell geht die Art aber insbesondere in Gebieten mit industrieller Landwirtschaft stark zurück (Léon-Cortéset al. 2000). Im mesophilen Grasland des Münsterlandes (Westfalen) nutzt L. phlaeas Maulwurfshaufen regelmäßig zur Eiablage (Streitbergeret al. 2014). Für die Eiablage werden Mikrohabitate mit einem hohen Anteil an Offenboden bzw. Maulwurfshaufen, einer geringen Krautschicht- und hohen Wirtspflanzendeckung präferiert (Abb. 6). Aufgrund der geringen Konkurrenz durch andere Pflanzenarten kommt R . acetosa an diesen Störstellen in höherer Deckung im Vergleich zu Zufallsstichproben vor (Streitbergeret al. 2014).
Ähnliche Beobachtungen konnten für H. comma , P. malvae und Z . purpuralis in Kalkmagerrasen des Diemeltales (Nordhessen/Ostwestfalen) gemacht werden. Alle drei Arten benötigen wärmebegünstige und offenbodenreiche Mikrohabitate für die erfolgreiche Entwicklung der Präimaginalstadien (Fartmann2004, 2006;Fartmann & Mattes2003). Ameisen- bzw. Maulwurfshaufen stellen in den Kalkmagerrasen aufgrund der offenen Vegetationsstruktur bzw. einer hohen Wirtspflanzendeckung im Vergleich zur Matrix-Vegetation bedeutende Eiablage- und Larvalhabitate für diese Schmetterlingsarten dar (Tab. 2). Gelbe Wiesenameise und Maulwurf sind ebenso wie ihre Haufen nahezu nur an den produktiveren, tiefgründigeren Hangfüßen und Plateaus der Kalkmagerrasen zu finden (Abb. 1a, 2, Abschnitt 2.1). Beide Ökosystem-Ingenieure haben also ihren Vorkommensschwerpunkt exakt in jenen Teilbereichen der Magerrasen, in denen niedrigwüchsige und lückige Vegetation fehlender oder sehr geringer Nutzungsintensität schnell im Zuge der Sukzession durch dichte und höherwüchsige Vegetation ersetzt und zum Mangelfaktor wird.
Für H . comma und Z . purpuralis sind die durch ein günstiges Mikroklima gekennzeichneten Haufen der Gelben Wiesenameise (Abb. 5) besonders wichtige Eiablage- bzw. Larvalhabitate (Streitberger & Fartmann2015, 2016). Hesperia comma ist stark von Störungen abhängig (Fartmann & Mattes2003,Thomaset al. 1986). Die Larven ernähren sich in den Kalkmagerrasen des Diemeltals monophag von Festuca ovina agg. Das Untergras kommt regelmäßig und in hoher Deckung auf den Ameisenhaufen vor (Streitberger & Fartmann2016).
Zygaena purpuralis ist als gelegebildende Art auf ausreichend Nahrung für die Larven angewiesen, um intraspezifische Konkurrenz zu vermeiden. Das Thymian-Widderchen ernährt sich monophag von Thymus -Arten, die hervorragend an die Grabeaktivität der Ameisen angepasst sind und hierdurch sogar gefördert werden (s. Abschnitt 2.1).
Folglich ist das günstige Nahrungsangebot (Tab. 2) ein weiterer wichtiger Grund für die Bevorzugung der Ameisenhaufen als Larvalhabitat durch Zygaena purpuralis . Vor allem in Magerrasen der kühlen Hochlagen des Diemeltales oder in Brachen mit dichter Vegetation, kühlem Mikroklima und geringer Thymianabundanz werden die Nester aufgrund des günstigen Mikroklimas und der hohen Wirtspflanzendeckung als Larvallebensräume von Z . purpuralis präferiert (Streitberger & Fartmann2015).
Für P. malvae stellen Maulwurfshaufen präferierte Eiablagehabitate in den Kalkmagerrasen dar (Streitberger & Fartmann2013). Zur Eiablage genutzt werden vor allem diejenigen Maulwurfshaufen, die eine hohe Deckung der Hauptwirtspflanze – Gewöhnlicher Odermennig ( Agrimonia eupatoria ) – aufweisen. Die Mikrohabitate erfüllen demnach die wichtigsten Bedingungen für eine erfolgreiche Larvalentwicklung von P. malvae : ein günstiges Mikroklima aufgrund einer offenen Vegetation und ein ausreichendes Angebot an Nahrung durch eine hohe Wirtspflanzenabundanz (vgl.Krämeret al. 2012a).
3 Schlussfolgerung
Die Ergebnisse der Studien verdeutlichen die große Bedeutung von Störungen und der Habitatheterogenität für die Förderung der Biodiversität im Grasland (vgl. auchMorris2000,Woodcock & Pywell2010). Die vorgestellten Ökosystem-Ingenieure übernehmen dabei eine Schlüsselrolle, indem sie durch ihre Lebensweise im Boden die Vegetation kleinräumig stören und lokal Mikrohabitate für konkurrenzschwache und thermophile Pflanzen- und Tierarten schaffen. Generell ist davon auszugehen, dass die durch die Ökosystem-Ingenieure geschaffenen Störstellen auch für andere thermophile Wirbellose eine große Bedeutung haben (vgl.King2006). Beispielswiese gibt es Hinweise auf eine bevorzugte Nutzung von Ameisen- und Maulwurfshaufen durch Feldheuschrecken zur Eiablage (Reck1993,Schulz2003,Waloff1950).
Die oberirdischen Erdnester der Gelben Wiesenameise sind Sonderstrukturen, die sich durch eine spezifische Vegetation auszeichnen. Vor allem für kleinwüchsige Pflanzenarten, wie konkurrenzschwache Moose, stellen die Nester bedeutende Lebensräume dar. Entscheidend für eine hohe Diversität und Abundanz dieser Moosarten scheint vor allem die Intensität der Bodenstörung zu sein. Insbesondere ältere oder verlassene Nester, die durch eine geringe Bodenstörung, aber ein noch spärliches Gefäßpflanzenvorkommen gekennzeichnet sind, weisen oft eine hohe Moosdeckung auf (eigene Beobachtung; vgl. auchMarstaller2005, 2007).
Durch die spezifische Vegetationsstruktur und das günstige Mikroklima sind die Störstellen der Ökosystem-Ingenieure auch wichtige Larvalhabitate für thermophile Schmetterlingsarten. Dies gilt in besonderer Weise innerhalb produktiver und dichtwüchsiger Graslandbestände oder in Brachen (Streitberger & Fartmann2013, 2014, 2015). Hier können die Ökosystem-Ingenieure durch ihre Grabtätigkeit die negativen Auswirkungen der Sukzession für diese Arten für eine gewisse Zeit kompensieren oder zumindest abmildern.
Dem Erhalt und der Förderung der Ökosystem-Ingenieure im Grasland kommt aufgrund des positiven Einflusses auf die Biodiversität eine besondere Bedeutung zu. Dies gilt vor allem für produktive und verbrachte Bestände, in denen die Störstellen der Ökosystem-Ingenieure meist die einzigen offenen Bodenstellen darstellen. Daher sollte auf Nutzungen, die eine Verdichtung des Bodens und eine Zerstörung der oberirdischen Strukturen bewirken verzichtet werden. Vor allem Mahd und ein zu hoher Rinderbesatz führen zur Zerstörung der Nester der Gelben Wiesenameise (eigene Beobachtung,King2006). Zur Erhaltung der Haufen von L . flavus ist eine extensive Hütebeweidung zu empfehlen. Handelt es sich um Brachen, ist zumindest eine gelegentliche Nutzung (z.B. in Form einer extensiven Schafbeweidung) notwendig, um die weitere Sukzession zu stoppen und den Fortbestand der Ameisenpopulation sicherzustellen (King2006,Waloff & Blackith1962). Frisch angelegte Nester sind aufgrund fehlender Vegetation besonders empfindlich gegenüber mechanischer Störung (King2006), so dass intensive Trittbelastungen vermieden werden sollten. Auf Düngung ist grundsätzlich zu verzichten, da L . flavus empfindlich auf Eutrophierung reagiert (Seifert1993).
Beim Europäischen Maulwurf ist hingegen eine gezielte Förderung der Art unter Berücksichtigung von Naturschutzaspekten schwierig. Die Intensität der Bodenstörung und die Populationsdichte des Maulwurfs sind einerseits eng mit der Regenwurmdichte korreliert(Edwardset al. 1999,Funmilayo1977). Die Regenwurmdichte ist vor allem von den Bodenverhältnissen und der Vegetation abhängig. Beispielsweise erhöht sich die Störung durch Maulwürfe bei Kalkung aufgrund eines verbesserten Nahrungsangebotes (Edwardset al. 1999). Andererseits bestimmen die Jahreszeit und die davon abhängige Nahrungsverfügbarkeit sowie die Bodenstruktur das Entstehen von Maulwurfshaufen (vgl.Atkinson2013,Edwardset al. 1999). So kommt es beispielsweise im Frühjahr und Herbst zu intensiver Störung durch den Maulwurf, da die Tiere während der Paarungszeit einen größeren Aktionsraum haben bzw. im Herbst tiefere Tunnel anlegen, wenn sich die Regenwürmer in tiefere Schichten zurückziehen (Edwardset al. 1999). Ein Walzen des Graslandes sollte generell unterbleiben, um die Maulwurfshaufen nicht zu zerstören.
Danksagung
Der vorliegende Artikel ist Tim King (Universität Oxford) gewidmet, der mit seinen Studien zu Lasius flavus umfangreiche Pionierarbeit zum Einfluss von Ökosystem-Ingenieuren auf die Biodiversität geleistet hat. Er war uns darüber hinaus ein wertvoller Diskussionspartner.
Literatur
Aus Umfangsgründen steht das ausführlicher Literaturverzeichnis unter www.nul-online.de (Webcode 2231) zur Verfügung.
Kontakt
Merle Streitberger studierte Landschaftsökologie an der Universität Münster und spezialisierte sich dabei auf Biozönologie. Im Jahr 2016 promovierte sie an der Universität Osnabrück zum Einfluss von Ökosystem-Ingenieuren auf die Biodiversität. Seit 2012 ist sie Mitarbeiterin in der Arbeitsgruppe von Prof. Fartmann und bearbeitet Forschungsprojekte zum Einfluss des Landnutzungs- und Klimawandels auf die Biodiversität und zu Natura 2000.
> Merle.Streitberger@uni-osnabrueck.de > www.fartmann.net/streitberger
Prof. Dr. Thomas Fartmann ist Ökologe und Biogeograph. Er leitet die Abteilung für Biodiversität und Landschaftsökologie an der Universität Osnabrück. Zu seinen Forschungs- und Lehrschwerpunkten zählen die Auswirkungen des rezenten Landnutzungs- und Klimawandels auf die Biodiversität (Global Change Ecology ). Darüber hinaus sind die Störungsökologie (Disturbance Ecology ) und Renaturierungsökologie (Restoration Ecology ) wichtige Themenfelder. Bislang hat er 160 wissenschaftliche Publikationen – darunter zehn Bücher – zur Tier- und Vegetationsökologie sowie Naturschutzbiologie veröffentlicht.
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen






Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.