Erhaltung und Produktion gebietseigener genetischer Vielfalt in Ex-situ -Populationen
Abstracts
Für viele seltene Baum- und Straucharten ist die Verfügbarkeit geeigneter Habitate in den letzten Jahrhunderten stark zurückgegangen. Heutige Bestände sind geprägt durch geringe Populationsgrößen, ungünstige Altersstrukturen, Hybridisierung mit nicht-heimischen Arten und – damit einhergehend – starken Verlusten an genetischer Vielfalt. Da eine In-situ -Erhaltung vieler Populationen oft nicht mehr möglich ist, sollten Schutzprogramme nicht nur die Erhaltung geeigneter Lebensräume, sondern auch die Produktion von angepasstem und genetisch vielfältigem Vermehrungsgut für Anreicherungspflanzungen oder die Etablierung neuer Vorkommen beinhalten.
In dieser Studie wird am Beispiel des Wildapfels ( Malus sylvestris (L.)Mil) vorgestellt, welche Möglichkeiten ein DNA-basiertes Qualitätsmanagement für die Ex-situ -Sicherung genetischer Ressourcen und die Produktion von Vermehrungsgut in speziellen Samenplantagen bietet: (a) DNA-Analysen erlauben eine präzise Unterscheidung artreiner Wildäpfel vom Kulturapfel und deren Hybriden; (b) der Genpool eines Vorkommensgebietes (= die gebietseigene genetische Vielfalt) kann repräsentativ rekonstruiert werden; (c) zur Sicherung der regionaltypischen gebietseigenen genetischen Vielfalt kann die Mindestgröße von Ex-situ -Populationen geschätzt werden; (d) an Vermehrungsgut aus Samenplantagen ist eine vereinfachte Herkunfts- und Identitätsprüfung (Zertifizierung) bei gleichzeitiger Optimierung der Beerntungsmöglichkeiten gegenüber natürlichen Vorkommen möglich.
Conservation and production of autochthonous genetic variation in ex-situ populations – Implementation of results from DNA-based studies using the example of the wild apple
For many of our rare tree and shrub species, the availability of suitable habitats has strongly decreased during the last centuries. Present-day stands are shaped by small population sizes, unfavourable demographic structures, and hybridisation with non-native species, going along with a heavy loss of genetic variation. Because in-situ preservation of many local populations is almost impossible, conservation programmes should include both the maintenance of suitable environments as well as the production of adapted and genetically diverse reproductive material for enrichment plantings or establishment of new populations.
This case study on Malus sylvestris L. (wild apple) describes the potentials of a DNA-based quality management for the ex-situ conservation of genetic resources and the production of reproductive material in special seed orchards: (A) DNA-analyses allow for an accurate discrimination between crab apple, domesticated apple and their hybrids; (B) the gene pool of regional provenances of indigenous species (= autochthonous genetic diversity) can be reconstructed; (C) the minimum size of ex-situ populations can be estimated in order to maintain as much as possible of the original genetic variation; (D) in contrast to in-situ populations, seed orchards allow both simplified identification and tracking methods for certification purposes as well as more efficient seed harvesting procedures.
- Veröffentlicht am
1 Einleitung
Das Baumartenspektrum mitteleuropäischer Laubwaldregionen war immer wieder einschneidenden Veränderungen unterworfen. Nicht nur natürliche Einflüsse (Eiszeiten), auch anthropogene Umgestaltungen der Wälder hatten gravierende Auswirkungen. Dazu zählen sowohl die nahezu vollständige Entwaldung großer Landstriche aufgrund des immensen Holzbedarfs in der frühindustriellen Phase als auch die Umwandlung von Wald in landwirtschaftliche Nutzfläche, was vor allem die typischen Wälder der besten Böden in den Niederungen und Flussauen stark dezimierte (vgl.Heyder & Schulze2010).
Aber nicht nur großflächige Rodungen, auch der Wandel der forstlichen Betriebsformen hat viele unserer heute seltenen Baumarten besonders beeinflusst. Zu nennen sind hier insbesondere die lichtbedürftigen und wenig konkurrenzkräftigen Baumarten wie z.B. der Wildapfel ( Malus sylvestris (L.) Mill), die Wildbirne ( Pyrus pyraster (L.)Burgsdorf), die Elsbeere ( Sorbus torminalis (L.)Crantz) und der Speierling ( Sorbus domestica L.). Im Nieder- und Mittelwaldbetrieb, die vom Mittelalter bis zur frühen Neuzeit weit verbreitete Waldnutzungsformen darstellten, waren die Lebensbedingungen für viele der genannten Baumarten günstiger als gegenwärtig. Durch ihr Stockausschlagsvermögen sowie ihre Fähigkeit zur Ausbildung von Wurzelbrut konnten sie sich damals gegenüber konkurrenzstarken Baumarten wie der Buche vielerorts behaupten. Außerdem zählten sie neben den Eichen im Oberholz vieler Mittelwälder zu den „fruchtbaren" Baumarten (Sieder2003). In den letzten Jahrhunderten hingegen führten Intensivierungen im Rahmen der klassischen Hochwaldwirtschaft, die durch dichte Bestände mit einem hohen Anteil schattenertragender, konkurrenzstarker Wirtschaftsbaumarten wie Fichte und Buche geprägt ist, zu einem schleichenden Rückgang an Lichtbaumarten. Heutige Vorkommen von Wildobst stellen somit oft nur Relikte früherer Waldformen dar (Höltken2005,Schoppa2000).
Die nähere Betrachtung der Situation des Wildapfels macht deutlich, dass eine In-situ -Erhaltung oft nicht mehr möglich ist. Geeignete Habitate sind sehr selten geworden (Verlust von Überflutungsgebieten im Hartholzauenbereich, vielerorts dichte Wirtschaftswälder) mit der Folge geringer Bestandsgrößen und dem Verlust der reproduktiven Vernetzung (vgl.Aas2013,Maurer2013). Erschwerend kommt die Eigenschaft der Selbstinkompatibilität (SI) des Wildapfels hinzu. Dieses genetisch festgelegte SI-System verhindert eine Befruchtung mit Eigenpollen bzw. Pollen mit gleichem SI-Genotyp und setzt für eine erfolgreiche generative Vermehrung geeignete Paarungspartner voraus. Dies kann die Reproduktionsfähigkeit in Gruppen aus vegetativer Vermehrung durch Wurzelbrut oder mit hohen Verwandtschaftsgraden immens erschweren. Ein weiterer Gefährdungsfaktor ist der Verlust der Artintegrität durch Hybridisierung mit Kulturäpfeln. Gerade genetisch identische Individuengruppen (Klongruppen) oder kleine Vorkommen mit hohen Verwandtschaftsgraden sind durch genetische Einkreuzung deshalb vermutlich besonders gefährdet (vgl.Reimet al. 2015).
Oberstes Ziel der Erhaltung einer genetischen Ressource ist ihre natürliche Verjüngung über Generationen vor Ort. Nur so kann die Vielfalt an Neukombinationen von Erbanlagen der natürlichen Auslese und damit natürlichen Anpassungsprozessen unterliegen (Frenzet al. 2009,Gregorius1996, 2001;Müller-Starck1995, 1996). Die ungünstige Populationsentwicklung des Wildapfels (Verlust seltener, autochthoner Vorkommen und damit verringerter genetischer Austausch zwischen Populationen, Überalterung etc.) hat aber vermutlich zu starken Verlusten an genetischer Vielfalt geführt(Heyder & Schulze2010: 18). Schutzprogramme sollten deshalb nicht nur auf Habitaterhaltung und waldbauliche Konkurrenzsteuerung setzen, sondern auch auf Anreicherungspflanzungen oder gar die Anlage neuer Vorkommen mit ausreichender genetischer Vielfalt. Da eine solche genetische Vielfalt in natürlichen Vorkommen aber kaum noch zu erwarten ist, bedarf es spezieller Ex-situ -Populationen zur generativen Erzeugung von Vermehrungsgut.
Deshalb soll dieser Beitrag Informationen zu folgenden Sachverhalten liefern:
- Wildnähe: Ein entscheidendes Kriterium für die Ex-situ- Erhaltung der genetischen Ressourcen von M. sylvestris ist die Beurteilung der Wildnähe der einzelnen Individuen. Bis vor wenigen Jahren standen ausschließlich morphologische Merkmale zur Verfügung (Abb. 1), deren Ausprägung aber stark von lokalen Umweltbedingungen beeinflusst sein kann. So kann die Blattbehaarung zwischen den Jahreszeiten unterschiedlich ausfallen und die Blüten- und Fruchtbildung je nach soziologischer Stellung über Jahre auch vollständig entfallen. Weiter kommt es durch Hybridisierung zwischen Wild- und Kulturformen zu fließenden Übergängen (vgl.Polzin & Wagner2013,Remmy & Gruber1993,Wagner1996). Genetische Methoden in Kombination mit der Tatsache, dass nahezu alle Kulturapfelsorten ihren Ursprung in Zentral-Asien haben (Gharghaniet al. 2009,Richardset al. 2009) und damit eine starke genetische Differenzierung gegenüber dem europäischen Genpool aufweisen, bieten Möglichkeiten der Artbestimmung mit einer wesentlich höheren Auflösung (Höltkenet al. 2014,Kleinschmitet al. 2012,Reimet al. 2013).
- Erhaltung genetischer Vielfalt : Anpassungsprozesse innerhalb von Populationen basieren auf der Existenz und der Selektion genetischer Variation. Eine dauerhafte Anpassungsfähigkeit an sich ändernde Umweltbedingungen ist demnach nur dann gewährleistet, wenn genügend genetische Vielfalt (Auswahlmöglichkeit) vorhanden ist (vgl.Gregorius1996, 1997). In dieser Studie soll auf die genetische Diversität von Ex-situ - im Vergleich zu In-situ -Beständen im Hinblick auf deren Potenziale zur Erhaltung genetischer Ressourcen eingegangen werden.
- Erhaltung gebietseigener genetischer Ressourcen : Die genetische Vielfalt äußert sich auch in einer räumlich differenzierten Anpassung von Populationen an unterschiedliche ökologische Rahmenbedingungen. Nicht nur die genetische Vielfalt insgesamt, auch die Verwendung der richtigen genetischen Ausstattung des gebietseigenen Pflanzenmaterials stellt daher aus naturschutzfachlicher Sicht einen wichtigen Beitrag zur Stabilität von Ökosystemen dar (Barschet al. 2012,Kowarik&Seitz2003,Seitzet al. 2007,Vollrath2006)
2 Material und Methoden
2.1 Pflanzenmaterial
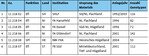
Ex-situ-Bestände : Insgesamt wurden sechs Ex-situ -Bestände (fünf Erhaltungsflächen und eine Samenplantage) vollständig beprobt und genetisch analysiert (Tab. 1). Diese Ex-situ -Bestände decken die nachSchmidt & Krause(1997) definierten Herkunftsgebiete I = Norddeutsches Tiefland, II.1 = Mitteldeutsches Tief- und Hügelland und IV.1 = Weser- und Hessisches Bergland ab.
In-situ-Wildapfelbestände und Kulturäpfel : Zu Vergleichszwecken (Wildnähe, genetische Vielfalt und Differenzierung) sind genetische Daten aus 35 bundesweiten Vorkommen (insgesamt 602 Individuen des Wildapfels) und Genotyp-Daten von 66 Kulturapfelsorten verwendet worden. Die bundesweit erfassten In-situ -Vorkommen stammen alle aus einem BLE-finanzierten Verbundprojekt, die Kulturapfelsorten sind an der Nordwestdeutschen Forstlichen Versuchsanstalt (NW-FVA) archiviert (BLE 2013,Höltkenet al. 2014).
2.2 Genetische Untersuchungen
Labormethoden : Alle Pflanzenproben wurden mit DNA-Markern (hier: sechs Kern-Mikrosatelliten) analysiert. Labortechnische Informationen wie DNA-Extraktion, PCR-Amplifikation, Kapillarelektrophorese und Details zu den verwendeten DNA-Markern sind inHöltkenet al. (2014) sowieKleinschmitet al. (2012) beschrieben.
Parameter der genetischen Vielfalt und Differenzierung : Als genetisches Vielfaltsmaß ist die durchschnittliche Anzahl an beobachteten Genvarianten (= Allelen) pro untersuchtem Genort ( NA ) angegeben. Zur Bestimmung der genetischen Differenzierung jeder einzelnen Population wurde das genetische Differenzierungsmaß DJ [0 DJ 1] berechnet (Gregorius1987). Dieses Maß vergleicht jedes einzelne Kollektiv von Individuen (die einzelnen Ex-situ - sowie In-situ -Populationen) mit dem Komplement der restlichen Populationen, also dem Genpool aller anderen Bestände. Ist DJ = 0, so repräsentiert die Population das gesamte Kollektiv in idealer Weise (= identische genetische Strukturen). Ist DJ = 1, so sind alle in der Population auftretenden Genvarianten (= Allele) in keiner der anderen Populationen vertreten. Eine solche Population gilt dann als vollständig von allen anderen differenziert und reproduktionsbiologisch isoliert. Die Gesamtdifferenzierung errechnet sich aus dem gewichteten Mittelwert der Einzelwerte von DJ .
Gruppierung in reproduktive Einheiten: Die Zuordnung der einzelnen Individuen zu reproduktiven Gruppen erfolgte mit dem Programm STRUCTURE 2.3.2 (Pritchardet al. 2009). Das Programm führt eine modellbasierte Bayessische Clustermethode durch, welche die genetischen Mischungsanteile jedes einzelnen Individuums quantifiziert und so die individuelle Zuordnung zu den verschiedenen Clustern (Reproduktionseinheiten) bestimmt.
Die Schätzung der genetischen Mischungsanteile in STRUCTURE erfolgte jeweils unter der Annahme von bestehendem genetischen Austausch (admixture model) und korrelierenden Allelhäufigkeiten zwischen den Populationen (correlated allele frequency model). Zur Schätzung der Mischungsanteile wurden unter der Annahme von je einem bis zehn Clustern (K = 1 bis 10) je zehn Läufe bestehend aus Monte-Carlo-Simulationen mit 10 000 Generationen „burn-in" und 10 000 beprobten Generationen durchgeführt. Basierend auf diesen Informationen wurden die konditionalen Wahrscheinlichkeiten für die Einordnung der Individuen in eine vorgegebene Anzahl an Clustern (hier K = 1 bis 10) errechnet. Anschließend wurde die Anzahl an Clustern mit der höchsten Wahrscheinlichkeit ermittelt(Earl2011, Evannoet al. 2005).
Die STRUCTURE-Analyse wurde hier für zwei Fragestellungen verwendet: (a) Identifizierung der Wildnähe der einzelnen Individuen der Ex-situ -Bestände; (b) Zugehörigkeit zu geographischen Reproduktionseinheiten und Beurteilung der regionalen Repräsentativität des Genpools der einzelnen Ex-situ -Bestände. Für letztere Fragestellung haben wir eine nachHubiszet al. (2009) modifizierte statistische Methode verwendet, die auch bei Datensätzen mit stark variierenden Populationsgrößen solche Strukturen effizient erkennt.
3 Ergebnisse und Diskussion
3.1 Wildnähe
Ein entscheidendes Kriterium für die Ex-situ- Erhaltung von M. sylvestris ist die Beurteilung der Wildnähe der einzelnen Individuen. Da die in Tab. 1 aufgeführten Ex-situ -Bestände schon vor der Entwicklung neuer genetischer Möglichkeiten begründet wurden, standen damals ausschließlich morphologische Merkmale zur Verfügung (vgl. Abb. 1).
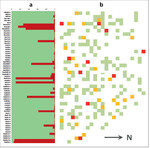
In Abb. 2a sind die Ergebnisse einer genetischen Inventur mit anschließender STRUCTURE-Analyse in der Wildapfel-Generhaltungsplantage Dassel (Az. 11 218 05, Tab. 1) dargestellt. Es zeigt sich, dass vor der Bereinigung ein mit durchschnittlich 14,6 % relativ hoher Kulturapfelanteil vertreten war, und zwar sowohl in Form nahezu reiner Kulturäpfel (> 90 % Wahrscheinlichkeit der Zugehörigkeit zur Gruppe der Kulturäpfel laut STRUCTURE) als auch Hybriden (10 bis 90 % Zugehörigkeitswahrscheinlichkeit). Abb. 2b zeigt die schematische Verteilung der einzelnen Komponenten auf der Fläche vor und nach der Bereinigung. Kulturäpfel und Hybriden werden entfernt, Fehlstellen (weiße Flächen = Ausfälle) können mit zuvor genetisch überprüftem Wildapfelmaterial künftig wieder aufgefüllt werden (Anmerkung: Pflanzenzahlen in der Skizze stimmen nicht mit der STRUCTURE-Grafik überein. Es handelt sich um eine Pfropflings-Plantage und jeder Genotyp ist mehrfach in unterschiedlicher Anzahl an Kopien vertreten).
Die Ex-situ -Erhaltungsflächen werden künftig hauptsächlich zur Gewinnung von Pfropfreisern für die Etablierung und Aufrechterhaltung von Samenplantagen zur Produktion von artreinem Wildapfel-Vermehrungsgut dienen. Denn auch diese Flächen sind nachweislich durch Einkreuzungen mit Kulturapfelsorten gefährdet. Selbst bei einer größeren Anzahl von Wildapfeleltern in erreichbarer Nähe wird immer noch ein hoher Anteil der Blüten mit Kulturapfelpollen bestäubt, wodurch unerwünschte Hybriden entstehen (nach eigenen Untersuchungen teilweise sogar über 50 %, unveröffentlicht). Die Abteilung Waldgenressourcen der NW-FVA hat deshalb eine spezielle Form der Wildapfel-Samenplantage entwickelt, die den Eintrag von Fremdpollen verhindert. Unter einem Insektenschutznetz übernehmen speziell gezüchtete Erdhummeln die Befruchtung der artreinen Wildformen. Eine solche Einrichtung liegt bei der hier untersuchten Samenplantage 11 218 08 der NW-FVA bereits vor (Material: nordhessisches Hügelland, siehe Tab. 1 und Abb. 3). Weitere Samenplantagen dieser Art, die auch andere Vorkommensgebiete abdecken sollen, sind im Aufbau.
3.2 Erhaltung genetischer Vielfalt
Die durchschnittliche beobachtete Anzahl an Genvarianten (=Allelen) pro Genort [ NA ] in den In-situ -Beständen fällt deutlich niedriger aus als auf den Ex-situ- Flächen (Abb. 4a). In 50 % der In-situ -Vorkommen sind zwischen 6,42 und 8,87 Allele pro Genort gefunden worden (siehe Box-Plot: Minimalwert 4,50 – Maximalwert 10,50), während in den Ex-situ -Beständen die Werte zwischen 11,33 und 14,67 deutlich höher ausfallen. Ein starker Zusammenhang ist auch zwischen der genetischen Vielfalt und der Populationsgröße zu beobachten. Die genetische Vielfalt steigt bei Populationsgrößen zwischen 5 und 30 Individuen zunächst sehr rasch an, wonach die Steigerung bei ca. 60 bis 80 Individuen pro Bestand deutlich nachlässt.
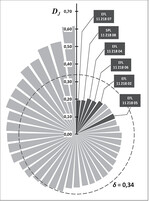
Stochastische Effekte aufgrund geringer Populationsgrößen führen aber nicht nur zum Verlust an genetischer Vielfalt, es kann auch zu zufälligen Verschiebungen in den Häufigkeiten von genetischen Varianten (Allelen) kommen (Gendrift). Die Folge ist eine erhöhte genetische Differenzierung zwischen Populationen. Die genetische Differenzierung DJ der einzelnen Vorkommen nimmt mit zunehmender Populationsgröße deutlich ab (Abb. 4b). In Abb. 5 stellt jedes Segment einen Bestand dar. Die Länge jedes Segments gibt die Höhe der genetischen Differenzierung an. Die durchschnittliche Differenzierung ist als Kreislinie abgebildet. Kleine In-situ -Bestände zeigen Differenzierungs-Werte von bis zu DJ = 0,614, d.h. sie unterscheiden sich in über 61 % der allelischen Varianten gegenüber dem gesamten restlichen Genpool aller untersuchten Wildäpfel. Mit den geringsten Differenzierungswerten schneiden wiederum die Ex-situ -Populationen ab. Mit Werten von DJ = 0,192 bis 0,276 liegen sie deutlich unterhalb der durchschnittlichen Gesamtdifferenzierung aller untersuchten Populationen von 34 % ( = 0,34) (Abb. 5).
Die Untersuchungsergebnisse zeigen, dass große Populationen, insbesondere die Ex-situ -Bestände, auch die größte genetische Vielfalt aufweisen und die Gesamtvariation am besten repräsentieren. Daraus kann der Schluss gezogen werden, dass der Verlust geeigneter Lebensräume und damit einhergehend die geringen reproduktionseffektiven Populationsgrößen somit der wichtigste Faktor für den starken Verlust an genetischer Vielfalt sind. Gerade seltene genetische Varianten sind in kleinen Populationen der Gefahr des Verlusts ausgesetzt.
Anhand dieser Zahlen lässt sich auch die Mindestgröße von Ex-situ -Beständen abschätzen, um einerseits möglichst viel genetische Variation zu bewahren, andererseits aber auch einen vertretbaren Kostenrahmen bei der Bestandesbegründung zu gewährleisten. Die Zahl von 50 bis 60 Genotypen pro Generhaltungseinheit sollte nach Abb. 4a mindestens eingehalten werden, um auch seltenere genetische Varianten zu sichern. Zu ähnlichen Schätzungen der Komponentenzahl von Ex-situ -Beständen zur Erhaltung genetischer Ressourcen kommen auchFrankelet al. (1995) undJohnsonet al. (2001).Gregorius(1980),Kang(1979) undNamkoong(1988) kommen anhand von Modellberechnungen zu höheren Werten (79 bis 117 Genotyp-Komponenten pro Ex-situ -Generhaltungseinheit).
Damit tragen die untersuchten Ex-situ -Bestände mit 82 bis 142 Genotypen (Tab. 1) sowohl nach experimentellen Datenerhebungen als auch nach Modellberechnungen wesentlich zur Sicherung der genetischen Vielfalt des Wildapfels bei. Die Samenplantage mit 53 Genotypen ist zwar die kleinste Ex-situ -Population, beinhaltet aber dennoch große Anteile der genetischen Vielfalt des gesamten Genpools des Wildapfels in Deutschland.
3.3 Erhaltung gebietseigener genetischer Ressourcen
Haben sich Pflanzenpopulationen einheimischer Sippen über längere Zeiträume und viele Generationen in einem Gebiet fortgepflanzt, kann das zu unterschiedlichen genetischen Strukturen zwischen Populationen der gleichen Art führen. Maßgeblich verursacht wird dieser Effekt durch selektive Prozesse variierender Umweltbedingungen (Klima- und Bodenverhältnisse, Topographie) sowie auch durch eine unterschiedliche Ausbreitungshistorie (vgl. auchJürgenset al. 2007).
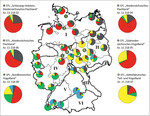
Deshalb soll bei Pflanzmaßnahmen in der freien Natur auch die genetische Differenzierung innerhalb des natürlichen Verbreitungsgebietes und damit die Herkunft des Vermehrungsgutes berücksichtigt werden, um einer möglichen Florenverfälschung vorzubeugen (Kowarik & Seitz2003). Für den Wildapfel ist in diesem Zusammenhang bereits ein populationsgenetischer Ansatz für In-situ- Bestände vorgenommen worden (siehe Studie vonHöltkenet al. 2014 mit Daten aus einem großen bundesweiten Projekt, BLE 2013). Mit Hilfe der STRUCTURE-Analyse konnte gezeigt werden, dass In-situ -Vorkommen des Wildapfels genetisch differenziert und geographisch in unterschiedliche genetische Gruppen aufgeteilt sind (potenzielle Reproduktions- und Anpassungseinheiten). Diese räumlich-genetische Untergliederung weist teilweise auffallende Ähnlichkeit mit den nachSchmidt & Krause(1997) auf Basis ökologischer Einheiten beschriebenen Vorkommensgebieten innerhalb Deutschlands auf. Diese in Abb. 6 dargestellte naturräumliche Gliederung umfasst sechs Regionen: I. Norddeutsches Tiefland, II. Mittel- und Ostdeutsches Tief- und Hügelland, III. Südostdeutsches Hügel- und Bergland, IV. Westdeutsches Bergland und Oberrheingraben, V. Süddeutsches Hügel- und Bergland sowie VI. Alpen und Alpenvorland. Die Studie vonHöltkenet al. (2014) untermauert die Bedeutung von Herkunfts- bzw. Vorkommensgebieten für die Verwendung von Vermehrungsgut.
In Abb. 6 wurden die bundesweiten Daten der o.g. Studie (kleine Kuchendiagramme in der Deutschlandkarte) um die hier erhobenen genetischen Daten der Ex-situ -Bestände ergänzt (große Kuchendiagramme links und rechts neben der Karte). Hier hat die STRUCTURE-Analyse die einzelnen Wildäpfel auf Basis der analysierten genetischen Variation in jeweils fünf reproduktive Gruppen eingeordnet (siehe fünf Farben in den Tortendiagrammen). Um die Unterschiede zwischen den einzelnen geographischen Regionen und die Zuordnung der Ex-situ -Bestände besser veranschaulichen zu können, wurden – anstelle der üblichen Eingruppierung von Einzelindividuen in Form von Balkendiagrammen – die Mittelwerte sowohl der jeweiligen In-situ -Vorkommen als auch der hier untersuchten Ex-situ -Generhaltungsbestände in Form von Kuchendiagrammen gewählt.
Auch wenn die Ex-situ -Bestände eine wesentlich geringere genetische Differenzierung zum Gesamtpool aller in Deutschland untersuchten In-situ -Wildapfelbestände aufweisen (siehe Abb. 4 und 5), spiegeln sie dennoch die regionaltypische genetische Ausstattung von Wildapfel-Populationen wider. Sie repräsentieren ziemlich genau die genetisch differenzierten Herkünfte, aus denen ihr Material stammt. Die Genotypen der Ex-situ -Erhaltungsfläche in Sachsen-Anhalt (Nr. 6) entsprechen nahezu vollständig der genetischen Gruppenzugehörigkeit der im Westteil des Vorkommensgebiets II untersuchten In-situ -Vorkommen (Mitteldeutsches Tief- und Hügelland, Farbe Gelb). Auch das Pflanzenmaterial der Erhaltungsquartiere Norddeutschlands (Nr. 1, 2 und 3) fügt sich klar in die genetischen Strukturen der Reproduktionseinheit „Norddeutsches Tiefland" ein (Farbe Rot). Einen besonderen Status haben die Samenplantage im nördlichen Hessen und das Erhaltungsquartier im südlichen Niedersachsen (Nr. 4 und 5). In diesem Gebiet kommt es vermutlich zu einer Vermischung verschiedener genetischer Gruppen (Nordwestdeutsches Tiefland, Mitteldeutsches Tief-und Hügelland, Westdeutsches Bergland). Dies entspricht auch den Ergebnissen zur Gruppenzugehörigkeit verschiedener In-situ -Bestände Nordhessens und Südniedersachsens.
Bei Betrachtung der genetischen Gruppenstrukturen der In-situ -Bestände (kleine Kuchendiagramme) fällt zwar eine Übereinstimmung mit den nachSchmidt & Krause(1997) beschriebenen Vorkommengebieten auf, einige Gebiete müssen aber durchaus differenzierter betrachtet und bei der Etablierung von Samenplantagen berücksichtigt werden. So ist in Vorkommensgebiet I (Norddeutsches Tiefland) der nordwestdeutsche Raum deutlich vom nordostdeutschen Raum getrennt (hier: Anteile roter bzw. dunkelgrauer Farbe in den Kuchendiagrammen). Ähnliches gilt für Vorkommensgebiet II. Hier sind die Bestände von Sachsen-Anhalt und Thüringen deutlich von Brandenburg zu unterscheiden (hier: Anteile gelber bzw. dunkelgrauer Farbe).
In Süddeutschland (insbesondere Bayern) sind leider nur sehr wenige Vorkommen in die Untersuchung aufgenommen worden. Hier sollten weitere Vorkommen für eine statistische Absicherung beprobt werden. Es deutet aber darauf hin, dass der südostdeutsche Raum (siehe die beiden bayerischen Bestände, hauptsächlich Farbe Blau) von Gebieten in Rheinland-Pfalz, Saarland, dem südlichen Hessen sowie dem westlichen Baden-Württemberg deutlich genetisch differenziert sind.
4 Schlussfolgerungen
Die Einbindung moderner genetischer Erfassungsmethoden in das Genressourcen-Management unserer heimischen Gehölzarten ermöglicht nicht nur die Erfassung der genetischen Vielfalt, sondern auch eine Beurteilung der räumlich-genetischen Differenzierung einer Art. Damit ist eine Untergliederung der natürlichen Verbreitung einer Spezies in Gebiete mit potenziell unterschiedlichen Ausbreitungs- und Anpassungsmustern möglich. Solche geographisch-genetischen Muster könnten die bislang als kritisch zu betrachtende statische Gebietsabgrenzung in sechs Vorkommensgebiete ablösen, da sich die einzelnen Arten aufgrund variierender populationsbiologischer Eigenschaften hinsichtlich genetischer Differenzierung und damit der Zahl und Größe ihrer potenziellen Vorkommensgebiete vermutlich deutlich unterscheiden. Hier besteht Handlungsbedarf, denn populationsgenetische Informationen liegen nur sehr beschränkt vor (vgl.Eimertet al. 2012,Höltkenet al. 2014,Kowarik & Seitz2003,Leinemannet al. 2010,Schmidt & Krause1997).
Grundlegende Daten genetischer Diversitätsmuster ermöglichen aber auch ein wissenschaftlich fundiertes Qualitätsmanagement bei Ex-situ -Maßnahmen (Generhaltungsquartiere, Samenplantagen etc.). Solche Maßnahmen sind insbesondere zum Schutz von seltenen und gefährdeten Baum- und Straucharten vielfach unumgänglich, da eine In-situ -Erhaltungsfähigkeit verbliebener genetischer Ressourcen oft zu unsicher erscheint (siehe Endberichte des BLE-Projekts „Erfassung und Dokumentation genetischer Ressourcen seltener und gefährdeter Baumarten in Deutschland", BLE 2013). Darüber hinaus kann die bundesweite Nachfrage nach artreinem und herkunftsgesichertem Vermehrungsgut durch natürliche Vorkommen allein nicht befriedigt werden. Hier bieten Ex-situ -Plantagen meist bessere Möglichkeiten. Im Falle von M. sylvestris werden dafür an der NW-FVA Wildapfelreiser auf besonders schwachwachsende Kulturapfel-Unterlagen (M27) gepfropft, die neben einem schwachen Wuchs vor allem eine frühe Blüte induzieren. Die frühe Fruktifikation auf kleinem Raum ermöglicht teilweise deutliche Steigerungen der Erntemengen und gleichzeitig einfachere und kostengünstigere Beerntungsmöglichkeiten mit geringem zeitlich-technischen Aufwand.
Die hier dargestellten Ergebnisse am Wildapfel zeigen, welche Möglichkeiten der Einsatz von DNA-Analysen für das Management genetischer Ressourcen, insbesondere in Form von Ex-situ -Erhaltungsbeständen, bietet:
- DNA- (Mikrosatelliten-) Analysen ermöglichen die Beurteilung der Artintegrität: Es kann eine präzise Auswahl von Individuen für die Einrichtung neuer Ex-situ -Bestände, aber auch die Bereinigung alter Ex-situ- Pflanzungen getroffen werden. Für die Produktion von artreinem Vermehrungsgut kann mit den heutigen genetischen Methoden auch ein optimiertes Samenplantagen-Management betrieben werden, insbesondere bei Arten, die mit gebietsfremdem Material hybridisieren, wie z.B. Wildapfel und Wildbirne mit Kultursorten oder die heimische Schwarzpappel Populus nigra L. mit der Nordamerikanischen P. deltoides Bartr. exMarshals auch mit deren Hybriden P. x canadensis (Dode). Der Fremdpolleneintrag kann standardmäßig kontrolliert werden, um bei einigen Arten (insbesondere Wildapfel und Wildbirne) auch besondere Schutzmaßnahmen einzuleiten (Abnetzung von Wildapfel- und Wildbirnen-Samenplantagen und Integration von Hummelvölkern als Pollenvektoren).
- Populationsgenetische Studien ermöglichen eine repräsentative Rekonstruktion des Genpools eines Vorkommensgebiets: Genetische Daten dienen nicht nur als Basis für die Erhaltung gebietseigenen Materials mit einer regionaltypischen genetischen Vielfalt (Angepasstheit an herkunftsspezifische Umweltbedingungen), es können auch Schätzungen zur Mindestgröße von Ex-situ -Generhaltungsbeständen getroffen werden, um die Erhaltung seltener genetischer Varianten sicherzustellen (Anpassungsfähigkeit an künftige Umweltbedingungen).
- DNA-basierte Zertifizierungssysteme zur lückenlosen Herkunfts- und Identitätsprüfung von Vermehrungsgut sind für Baumarten, die dem Forstvermehrungsgutgesetz (FoVG) unterliegen, schon entwickelt worden und basieren auf referenzprobengestützten Systemen (Konnert&Hussendörfer2002;Konnert&Hosius2008). Bei Vermehrungsgut aus Ex-situ -Beständen genügt der Vergleich der genetischen Fingerabdrücke zwischen Pflanzen in Mutterquartieren und deren vegetativ vermehrten Nachkommen (z.B. Schwarzpappel) oder es können Elternschaftsanalysen bzw. auf Wahrscheinlichkeitsberechnungen basierende Zuordnungsverfahren bei generativ vermehrtem Material aus Samenplantagen eingesetzt werden (Höltkenet al. 2013).
Literatur
Aas, G. (2013):Der Wildapfel – Biologie und Ökologie einer gefährdeten Baumart. LWF Wissen 73, 7-14.
Barsch, F., Heym, A., Nehring, S. (2012): Leitfaden zur Verwendung gebietseigener Gehölze. Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (BMU), Hrsg., Bonn.
BLE (2013): Erfassung und Dokumentation genetischer Ressourcen seltener und gefährdeter Baumarten in Deutschland. Online-Endbericht Wildapfel, 126 S. (abgerufen am 10.10.2016).
Earl, D.A.,von Holdt, B.M.(2011): STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method. Conservation Genetics Resources 4, 359-361.
Eimert, K., Rückert, F.-E., Schröder, M.-B. (2012):Genetic diversity within and between seedstock populations of several German autochthonous provenances and conventionally propagated nursery material of blackthorn (Prunus spinosa L.). Plant Syst. Evol. 298, 609-618.
Evanno, G., Regnaut, S.,Goudet, J.(2005): Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study. Molecular Ecology 14, 2611-2620.
Frankel, O.H., Brown, A.H.D., Burdon, J.J.(1995): The Conservation of Plant Biodiversity. Cambridge University Press, Cambridge, 299 S.
Frenz, W., Hellenbroich, T., Seitz B. (2009):Anpflanzung von Gehölzen gebietseigener Herkünfte in der freien Landschaft – rechtliche und fachliche Aspekte in der Vergabepraxis. BfN-Skripten 262, 96 S.
Gharghani, A., Zamani, Z., Talaie A., Oraguzie, N.C., Fatahi R., Hajnajari, H., Wiedow, C., Gardiner, S.E. (2009):Genetic identity and relationships of Iranian apple (Malus xdomestica Borkh.) cultivars and landraces, withMalus species and representative old apple cultivars based on simple sequence repeat (SSR) marker analysis. Genetic Resources & Crop Evolution 56, 829-842.
Gregorius, H.-R.(1980): The probability of losing an allele when diploid genotypes are sampled. Biometrics 36, 643-652.
– (1987): The relationship between the concepts of genetic diversity and differentiation. Theor. Appl. Genet. 74, 397-401.
– (1996): The contribution of the genetics of populations to ecosystem stability. Silvae Genetica 45, 2267-2271.
– (1997): Genetische Grundlagen der Ökosystemstabilität. Forstw. Cbl. 116, 29-38.
– (2001): Sustainaible treatment of resources: The genetic basis. In:Müller-Starck, G., Schubert, R., eds., Genetic Response of Forest Systems to Changing Environmental Conditions, Kluwer Academic Publishers, Dordrecht, Boston, London.
Heyder, J.C., Schulze, L. (2010):Förderung der Biodiversität: Genetische Vielfalt im Wald – ein Ratgeber für die Waldbewirtschaftung. Landesbetrieb Wald und Holz NRW.
Höltken,A.M. (2005): Genetische Untersuchungen zu den Voraussetzungen und Konsequenzen einer rezedenten Lebensweise am Beispiel der Vogelkirsche (Prunus avium L.). Diss. Fakultät für Forstwissenschaften und Waldökologie, Georg-August-Universität Göttingen.
–, Degen, B., Rogge, M. (2013): DNA-Analysen für den Nachweis der Verwendung gebietseigener Gehölze. Jahrbuch der Baumpflege, Haymarket Media, 259-265.
–, Steiner, W., Kleinschmit, J.R.G. (2014): Artintegrität und geographisch-genetische Strukturen des heimischen Wildapfels (Malus sylvestris L.). Allg. Forst- u. J.-Ztg. 185, 285-296.
Hubisz, M.J., Falush, D., Stephens, M.,Pritchard, J.K.(2009): Inferring weak population structure with the assistance of sample group information. Mol. Ecol. Res. 9, 1322-1332.
Johnson, R., Clair, S., Lipow, S (2001):Genetic conservation in applied tree breeding programs. In: Proceedings ITTO conference onin-situ andex-situ conservation of commercial tropical trees, Miscellaneous Publication, 215-230.
Jürgens, A.H., Seitz, B., Kowarik, I. (2007):Genetic differentiation ofRosa canina (L.) at regional and continental scales. Plant Syst. Evol. 269, 39-53.
Kang, H.(1979): Designing a tree breeding system. In: Proceedings Seventeenth Meeting Canadian Tree Improvement Association, Gander, Newfoundland, 51-66.
Kleinschmit, J.R.G., Hosius, B., Leinemann, L.(2012): Gefährdung von Wildapfelsamenplantagen durch Genfluss – Risk of gene flow in wild apple seed orchards. Forstarchiv 83, 19-25.
Konnert, M., Hosius, B. (2008): Zur Kontrolle und Zertifizierung von forstlichem Vermehrungsgut unter Nutzung von Labormethoden. In:Gebhardt, K.,Hrsg., Herkunftskontrolle an forstlichem Vermehrungsgut mit Stabilisotopen und genetischen Methoden, Nordwestdeutsche Forstliche Versuchsanstalt, Hann. Münden, 132-139.
–, Hussendörfer, E. (2002): Herkunftssicherung bei forstlichem Vermehrungsgut durch Referenzproben. Allg. Forst- und J.-Ztg. 173, 97-104.
Kowarik, I., Seitz, B. (2003):Perspektiven für die Verwendung gebietseigender („autochthoner") Gehölze. Neobiota 2, 3-26.
Leinemann, L., Kahlert, K., Arenhövel, W., Voth, W., Hosius, B.(2010): Einblicke in genetische Variationsmuster bei der GattungSorbus in Thüringen. Allg. Forst- und J.-Ztg. 181, 169-174.
Maurer, W.D.(2013): Baum des Jahres 2013: Der Wildapfel (Malus sylvestris ). Forstinfo 1/13, 6-8.
Müller-Starck, G. (1995):Protection of genetic variability in forest trees. Forest Genetics 2, 121-124.
–(1996):Beiträge der Forstgenetik zur nachhaltigen Waldbewirtschaftung. In:Müller-Starck, G.,Hrsg.,Biodiversität und nachhaltige Forstwirtschaft, ecomed, Landsberg, 259-283.
Namkoong, G.(1988): Sampling for germplasm collections. HortScience 23, 79-81.
Polzin, W.-P., Wagner, I. (2013):Isoenzymanalytische Untersuchungen an einem Apfelbaum (Malus , Rosaceae) in Stubbendorf, Landkreis Rostock, zur Klärung des Einflusses vonMalus xdomestica Borkh.Auf den Wildstatus. Tagungsband 23. Nordische Baumtage, Rostock/Warnemünde, 12.-14. Juni 2013, 42-46.
Pritchard, J.K., Wen, X., Falush, D.(2009): Documentation for structure software: Version 2.3. pritsch.bsd.uchicago.edu/structure.html (abgerufen am 21.03.2016).
Reim, S., Höltken, A.M., Höfer, M. (2013):Diversity of the European indigeneous wild appleMalus sylvestris (L.) Mill. in the East Ore Mountains, Osterzgebirge, Germany: II. Genetic characterisation. Genet. Resources Crop Evol. 60, 879-892.
–,Proft, A., Heinz, S., Lochschmidt, F., Höfer, M., Tröber, U., Wolf, H.(2015): Pollen movement in aMalus sylvestris population and conclusions for conservation measures. Plant Genetic Resources 1, 12-20.
Remmy, K., Gruber, F. (1993):Untersuchungen zur Verbreitung und Morphologie des Wildapfels (Malus sylvestris (L.) Mill.). Mitt. Dtsch. Dendr. Ges. 81, 71-94.
Richards, C.M., Volk, G.M., Reilley, A.A., Henk, A.D., Lockwood, D.R., Reevers, P.A., Forsline P.L. (2009):Genetic diversity and population structure inMalus siversii , a wild progenitor species of domesticated apple. Tree Genetics & Genomes 5, 339-347.
Schmidt, P.A., Krause, A. (1997):Zur Abgrenzung von Herkunftsgebieten bei Baumschulgehölzen für die freie Landschaft. Natur und Landschaft 72, 92-95.
Schoppa,F.N. (2000): Konsequenzen wald- und forstgeschichtlicher Entwicklungen für die aktuelle genetische Zusammensetzung von Waldbaumpopulationen in Mitteleuropa. Diss. Fakultät für Forstwissenschaften und Waldökologie, Georg-August-Universität Göttingen.
Seitz, B., Jürgens, A., Kowarik, J. (2007):Erhaltung genetischer Vielfalt: Kriterien für die Zertifizierung regionalen Saat- und Pflanzguts. BfN-Skripten 208, 48 S.
Sieder, P.(2003): Angewandter Waldbau, Waldbausysteme und strategien. Waldbau zur Jahrtausendwende, Shaker, Aachen.
Vollrath, B.(2006): Autochthonie im Praxistest: Vergleichende Untersuchungen bei Gehölzanpflanzungen. AFZ-Der Wald 8, 435-437.
Wagner, I.(1996): Zusammenstellung morphologischer Merkmale und ihrer Ausprägungen zur Unterscheidung von Wild- und Kulturformen des Apfels (Malus ) und des Birnbaums (Pyrus ). Mitt. Dtsch. Dendr. Ges. 82, 87-108.
Fazit für die Praxis
- Ungünstige Populationsstrukturen, Hybridisierung und ein damit verbundener hoher Verlust an genetischer Vielfalt machen eineIn-situ -Erhaltung vieler gefährdeter Baum- und Straucharten, wie z.B. dem Wildapfel, kaum möglich.
- Natürliche Vorkommen decken die Nachfrage nach genetisch vielfältigem, gebietseigenem und angepasstem Vermehrungsgut meist nicht ab;Ex-situ- Plantagen bieten deutlich gesteigerte Erntemengen bei zeitlich-technisch einfacheren Beerntungsmöglichkeiten.
- Genetische Inventuren in natürlichen Populationen erlauben die Erfassung vorhandener genetischer Vielfalt und Differenzierung und damit eine wissenschaftlich-fundierte Untergliederung genetischer Ressourcen in regional begrenzte Vorkommensgebiete.
- DNA-Daten ermöglichen eine optimale Zusammenstellung vonEx-situ -Populationen: Rekonstruktion des Genpools eines Vorkommensgebiets (gebietseigene genetische Vielfalt), optimale Anzahl an Genotypen zur vollständigen Erfassung genetischer Vielfalt, Artreinheit.
- Herkunfts- und Identitätskontrollen (Zertifizierung) von gehandeltem Vermehrungsgut ausEx-situ -Plantagen können mit Hilfe genetischer Methoden effizient und einfach durchgeführt werden.
Kontakt
Dr. Aki M. Höltken leitet das Sachgebiet „Forstgenetische Analysen" in der Abteilung Waldgenressourcen der Nordwestdeutschen Forstlichen Versuchsanstalt (Hann. Münden). Wichtige Arbeitsschwerpunkte sind DNA-basierte Methoden zur Erfassung, Erhaltung und Nutzung genetischer Vielfalt heimischer Waldbaumarten. Inventuren und Langzeit-Monitoring dienen als Grundlage für Erhaltungsmaßnahmen sowie zur Erkennung anthropogener Einflüsse auf forstgenetische Ressourcen.
Dr. Anne Hennig ist Diplom-Biologin und war von 2011 bis 2016 wissenschaftliche Mitarbeiterin in der Abteilung Waldgenressourcen der NW-FVA (Nordwestdeutsche Forstliche Versuchsanstalt). Einer ihrer Arbeitsschwerpunkte lag in der Analyse populationsgenetischer Daten seltener Baumarten.
Dr. Jörg Kleinschmit leitet seit Oktober 2016 die Abteilung Waldnaturschutz an der FVA Baden-Württemberg. Davor leitete das Sachgebiet „Erhaltung und nachhaltige Nutzung forstlicher Genressourcen" der Abteilung Waldgenressourcen der Nordwestdeutschen Forstlichen Versuchsanstalt (NW-FVA) in Hann. Münden. Schwerpunkte seiner Arbeit liegen in der Erfassung, Sicherung und Nutzung forstlicher Genressourcen.
> joerg.kleinschmit@forst.bwl.de
Hans Jürgen Arndt , Abteilung Waldgenressourcen der Nordwestdeutschen Forstlichen Versuchsanstalt, Hann. Münden
> hans-juergen.Arndt@nw-fva.de
Dr. Wilfried Steiner , Abteilung Waldgenressourcen der Nordwestdeutschen Forstlichen Versuchsanstalt, Hann. Münden
Barrierefreiheits-Menü
Schriftgröße
Kontrast
Menü sichtbar
Einstellungen



![Abb. 4: Durchschnittliche Anzahl beobachteter Allele pro Genort [N<sub>A</sub> ] und genetische Differenzierung [D<sub>J</sub> ] in Abhängigkeit von der PopulationsgrößeP<sub>N</sub> (Anzahl Individuen), R<sup>2</sup>= Bestimmtheitsmaß;In-situ -Bestände als Kreuze (×);Ex-situ -Bestände als schwarze Punkte ( ¿ ); Box-Plots nur fürIn-situ -Bestände (×).
Mean number of observed alleles per gene locus [N<sub>A</sub>] and genetic differentiation [D<sub>J</sub>] as a function of population size P<sub>N</sub>(number of individuals), R <sup>2</sup>= coefficient of determination; in-situ stands marked as crosses ( ×); ex-situ stands as black dots ( ¿ ); box plots only for the values of in-situ stands ( ×).](https://www.nul-online.de/vorlagen/webapp/cache/cms/nul04-17-inhalt-ak6-seite-130-mt-grafik-rahmenid-95374_gu2dcmbyga3a-150x131.jpg)
Zu diesem Artikel liegen noch keine Kommentare vor.
Artikel kommentierenSchreiben Sie den ersten Kommentar.